作者:董海燕 李力,广西医科大学附属肿瘤医院妇瘤科暨区域性高发肿瘤早期防治研究教育部重点实验室,
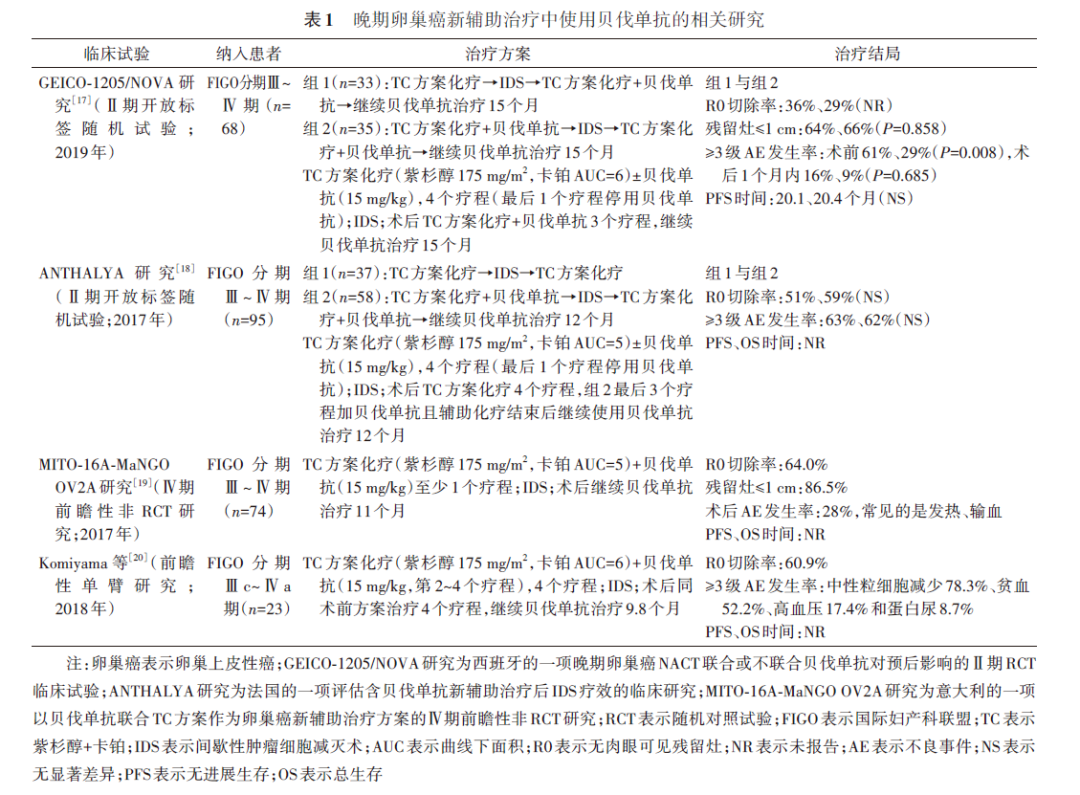
南宁 530021 通信作者:李力, Email:lili@gxmu.edu.cn引用本文:董海燕,李力. 卵巢上皮性癌新辅助治疗的研究进展[J]. 中华妇产科杂志,2025,60(01):71-78.DOI:10.3760/cma.j.cn112141-20240930-00532卵巢上皮性癌(卵巢癌)在妇科恶性肿瘤中的病死率最高,预后最差,对于不能行满意肿瘤细胞减灭术的晚期卵巢癌患者,新辅助治疗成为首选。单纯新辅助化疗的疗效有限且可能诱导耐药,不利于患者预后,而靶向治疗、聚二磷酸腺苷核糖聚合酶抑制剂(PARPi)治疗、免疫治疗和腹腔热灌注化疗(HIPEC)的疗效显著且毒副反应可接受,有望成为颇具前景的替代方案。本文对国内外应用靶向治疗、PARPi治疗、免疫治疗和HIPEC作为晚期卵巢癌新辅助治疗方案的研究进行了全面综述,为改进卵巢癌新辅助治疗的用药方案提供了理论依据和研究思路。卵巢上皮性癌(卵巢癌)是病死率最高的妇科恶性肿瘤,大多数患者在确诊时已为晚期,对于不能行满意肿瘤细胞减灭术的患者,新辅助化疗(neoadjuvant chemotherapy,NACT)后行间歇性肿瘤细胞减灭术(interval debulking surgery,IDS)是标准的治疗方式。但是,尽管严格接受了标准的NACT和IDS,卵巢癌患者的5年生存率仍然只有30%~40%,大多数患者2~3年后会复发,且几乎所有患者都会对化疗产生耐药 [ 1 ] 。近年来,卵巢癌靶向治疗、聚二磷酸腺苷核糖聚合酶抑制剂(poly adenosine diphosphate ribose polymerase inhibitor,PARPi)治疗、免疫治疗和腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)成为研究的热点,有望突破传统的治疗模式,改善患者预后。本文结合国内外的研究,对卵巢癌的新辅助治疗模式进行深入探讨,从卵巢癌新辅助治疗的存在问题、NACT的患者选择及疗程数、新辅助治疗的新模式及其临床应用等方面深入阐述目前卵巢癌新辅助治疗的进展及面临的问题,并提出思考。卵巢癌新辅助治疗主要是指在术前通过化疗、靶向治疗、免疫治疗等方式使得肿瘤细胞缺血、坏死,减少肿瘤负荷,提高手术成功率,同时降低手术并发症的发生率,延长患者生存时间,提高其生命质量。铂类药物是所有化疗药物中的关键药物,目前尚未有其他药物可以取代。铂耐药是卵巢癌复发和预后差的主要原因。对于无法行满意肿瘤细胞减灭术的晚期卵巢癌患者,以铂类药物为基础的NACT为其带来了希望。多项随机对照试验(randomized controled trial,RCT)表明,NACT后行IDS的疗效不劣于初次肿瘤细胞减灭术(primary debulking surgery,PDS) [ 2 ] 。2010年,欧洲癌症研究与治疗组织(EORTC)进行的前瞻性RCT研究比较了Ⅲc~Ⅳ期卵巢癌患者行NACT+IDS与PDS的疗效,结果显示,两者的无进展生存(progression-free survival,PFS)时间和总生存(overall survival,OS)时间分别比较均无明显差异(中位PFS时间均为12个月,中位OS时间分别为30、29个月; P均>0.05) [ 3 ] 。同样,英国和新西兰的87家医院包含504例患者的Ⅲ期非劣效性RCT研究(即CHORUS研究)得出相同的结论,NACT+IDS组与PDS组的PFS时间分别为12.0、10.7个月( HR=0.91,95% CI为0.76~1.09),OS时间分别为24.1、22.6个月( HR=0.87,95% CI为0.72~1.05),术后28 d内3~4级不良事件(adverse event,AE)发生率NACT+IDS组更低(分别为14%、24%; P=0.007) [ 4 ] 。然而,部分RCT研究和荟萃分析发现,NACT+IDS比PDS表现出较差的PFS时间和较差或非劣性OS时间。一项纳入161例患者的前瞻性队列研究显示,与NACT+IDS组相比,PDS组的PFS时间显著延长( P=0.029),而两组的OS时间无显著差异 [ 5 ] 。意大利的一项纳入384例接受NACT+IDS或PDS治疗的多中心回顾性研究也得出了相似的结论,NACT+IDS患者的2年、5年和7年PFS率分别为43.8%、12.5%和12.5%,显著低于PDS患者(分别为65.8%、40.8%和39.3%; P=0.001);NACT+IDS患者的2年、5年和7年OS率分别为87.1%、41.8%和32.6%,显著低于PDS患者(分别为96.4%、69.3%和50.4%; P=0.001) [ 6 ] 。随着研究的深入,发现接受含铂NACT患者的铂耐药复发时间更短,复发率更高。超过3个疗程的含铂NACT会增加铂耐药的风险 [ 7 ] 。相关的机制目前尚不清楚,大量的基础研究及临床研究显示,铂耐药是由多因素共同作用产生的结果,包括肿瘤干细胞的激活及代谢重编程,肿瘤微环境的改变,肿瘤细胞DNA损伤修复能力增强,细胞凋亡功能受抑制,化疗药物转运能力降低,药物外排泵能力增强,导致肿瘤细胞内药物蓄积减少、细胞解毒能力增强等 [ 8 ] 。为避免和延缓铂耐药的产生,研究者对NACT的患者选择及疗程数进行严格筛选和把控,新的新辅助治疗模式也应运而生。1. 患者选择:卵巢癌NACT的患者选择需要多方面评估,包括肿瘤负荷、手术耐受性、体能状况、病理类型及对化疗的潜在反应等。4项RCT研究包括EORTC-55971研究 [ 3 ] 、CHORUS研究 [ 4 ] 、日本临床肿瘤研究组(JCOG)-0602研究 [ 9 ] 和意大利的一项比较高肿瘤负荷晚期卵巢癌初次手术与NACT的Ⅲ期临床试验(即SCORPION研究) [ 10 ] 为NACT用于晚期卵巢癌提供了有利依据,可通过Suidan评分、Fagotti评分以及Mayo分类算法等对晚期卵巢癌患者的初始治疗进行分流,给予PDS或NACT。NACT适用于卵巢浆液性癌、卵巢子宫内膜样癌等对含铂化疗敏感的卵巢癌类型,对于化疗不敏感的卵巢癌类型及非上皮性卵巢恶性肿瘤则不适用。2. 疗程数:德国的一项评估NACT应用多少个疗程疗效更好的多中心Ⅱ期RCT研究(即PRIMOVAR-1研究)结果表明,NACT治疗3个疗程与2个疗程对化疗反应率、IDS中所达到的肿瘤细胞减灭程度、手术时间、手术复杂度、PFS时间和OS时间分别比较均无显著差异 [ 11 ] 。美国纪念斯隆-凯特琳癌症中心的团队 [ 12 ] 对199例新诊断卵巢癌患者的研究发现,与接受3~4个疗程NACT的患者相比,接受≥5个疗程NACT患者的PFS时间( HR=2.20,95% CI为1.45~3.33, P<0.001)和OS时间( HR=2.78,95% CI为1.37~5.63, P=0.016)更短,预后更差。但Bese等 [ 13 ] 的研究回顾性分析了219例晚期卵巢癌患者,发现接受3~4个疗程与接受6个疗程含铂NACT患者的无病生存时间和OS时间分别比较均无显著差异。大多数涉及NACT的研究在IDS之前使用3~4个疗程NACT,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南 [ 14 ] 建议在行IDS之前进行3~4个疗程的NACT,也可根据临床医师的判断在进行4~6个疗程NACT后行IDS,术后继续辅助化疗至少3个疗程,总疗程数为6~8个。绝大多数研究均为回顾性研究,缺乏大样本量前瞻性RCT研究等高质量研究,NACT的最佳疗程数仍存在争议。1. 血管生成抑制剂治疗:目前,最常用的血管生成抑制剂是贝伐单抗,根据美国妇科肿瘤学组(GOG)-0218研究 [ 15 ] 和一项针对初治晚期卵巢癌的Ⅲ期临床研究(即ICON7研究) [ 16 ] 结果,贝伐单抗被纳入了晚期卵巢癌肿瘤细胞减灭术后的一线治疗和维持治疗。GOG-0218和ICON7研究表明,对于Ⅳ期、合并腹水、有复发高风险因素[包括美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分较差、病理类型为浆液性癌、治疗前较高的血清癌抗原125(cancer antigen 125,CA 125)水平和术后有残留灶]的卵巢癌患者,联合贝伐单抗可延长其PFS和OS时间。因为需行NACT的卵巢癌患者往往为Ⅲc~Ⅳ期、合并腹水、有复发高风险因素者,那么在新辅助治疗阶段应用贝伐单抗是否可以改善手术结局,延长患者的PFS和OS时间,值得妇科肿瘤医师思考。几项前瞻性RCT研究探讨了在以铂类药物为基础的化疗方案中加入贝伐单抗作为新辅助治疗方案对卵巢癌患者预后的影响,见 表1 。其中,西班牙的一项晚期卵巢癌NACT联合或不联合贝伐单抗对预后影响的Ⅱ期RCT研究(即GEICO-1205/NOVA研究)的初步结果显示,与不联合贝伐单抗组比较,标准的紫杉醇+卡铂(TC)方案联合贝伐单抗组患者IDS的无肉眼可见残留灶(no visible residual disease,R0)切除率、手术结局(包括手术时间、住院时间、入住重症监护病房的时间、输血率和术后并发症发生率)、中位PFS时间、中位OS时间均无显著差异,但联合组患者较不联合组患者≥3级AE的发生率更低(NACT阶段分别为29%、61%, P=0.008;术后1个月内分别为9%、16%, P=0.685) [ 17 ] 。法国的一项评估含贝伐单抗新辅助治疗后IDS疗效的临床研究[即ALTHALYA研究;国家临床试验(national clinical trial,NCT)01739218]得出了相似的结论,联合贝伐单抗组患者IDS的R0切除率、手术结局、≥3级AE发生率分别与不联合贝伐单抗组比较均无显著差异 [ 18 ] 。意大利的一项以贝伐单抗联合TC方案作为卵巢癌新辅助治疗方案的Ⅳ期前瞻性非RCT研究(即MITO-16A-MaNGO OV2A研究;NCT01706120)显示,其IDS术后86.5%患者的残留灶≤1 cm,术后常见的并发症是发热和输血,无死亡病例 [ 19 ] 。另一项前瞻性单臂研究显示,23例新诊断为晚期卵巢癌的患者接受了4个疗程的新辅助治疗(前3个疗程联合贝伐单抗),IDS的R0切除率为60.9%(95% CI为38.5%~80.3%),化疗反应率为86.9%(95% CI为66.4%~97.2%),化疗期间≥3级AE为中性粒细胞减少(78.3%)、贫血(52.2%)、高血压(17.4%)和蛋白尿(8.7%),无≥3级手术并发症发生 [ 20 ] 。这些研究数据初步表明,TC方案化疗联合贝伐单抗是安全的,对于最初无法手术切除的晚期卵巢癌患者,联合贝伐单抗治疗可提高手术的R0切除率,但其PFS及OS时间没有明显延长。这些前瞻性研究的样本量小,存在局限性,对于贝伐单抗是否获益仍需更多大样本量的高质量研究数据。贝伐单抗有导致高血压、蛋白尿、肠梗阻、胃肠道穿孔、切口愈合不良等风险 [ 20 ] ,欧洲的指南 [ 21 ] 推荐贝伐单抗可在IDS前后给药,但术前需停药至少4~6周;我国的妇科肿瘤抗血管内皮生长因子单克隆抗体临床应用指南 [ 22 ] 给予了相同推荐。2024年的NCCN指南 [ 14 ] 推荐NACT中可联合或不联合贝伐单抗。
2. PARPi治疗:PARPi是一种基于合成致死性原理的新型小分子靶向药物,可通过竞争性抑制聚二磷酸腺苷核糖聚合酶的活性影响DNA修复过程,从而杀死肿瘤细胞。3项包含多个国家和地区的国际性临床试验评估了奥拉帕利(olaparib)、尼拉帕利(niraparib)和鲁卡帕利(rucaparib)在卵巢癌一线化疗后维持治疗中的安全性和有效性,其中SOLO-1研究 [ 23 ] 评估了一线含铂化疗后BRCA基因突变的卵巢癌患者使用奥拉帕利单药维持治疗的安全性和有效性,PRIMA/ENGOT-OV26/GOG-3012研究 [ 24 ] 评估了一线含铂化疗后卵巢癌患者使用尼拉帕利单药维持治疗的安全性和有效性,ATHENA研究 [ 25 ] 评估了新诊断的卵巢癌患者一线化疗后使用鲁卡帕利和纳武利尤单抗作为维持治疗的安全性和有效性,这3项研究奠定了PARPi在卵巢癌维持治疗中的地位。中国的一项Ⅲ期随机临床试验(即PRIME研究)显示,无论术后病灶残留状态和生物标志物状态如何,尼拉帕利用于新诊断的晚期卵巢癌患者单药维持治疗可延长其PFS时间 [ 26 ] 。中国卵巢癌PARPi临床应用指南(2022版) [ 27 ] 推荐PARPi用于卵巢癌的一线维持治疗及铂敏感复发性卵巢癌的治疗。PARPi彻底改变了卵巢癌的治疗模式,基于PARPi的重要作用,有学者提出,PARPi对晚期卵巢癌的新辅助治疗是否有同样作用?这值得妇科肿瘤医师进一步探索。美国的一项评估奥拉帕利单药作为新辅助治疗的窗口试验(即NOW研究;NCT03943173)显示,在BRCA基因突变的卵巢癌患者中,经过2个疗程的奥拉帕利单药新辅助治疗后,达部分缓解者占53.8%,IDS的R0切除率为85.7% [ 28 ] 。Harano等 [ 29 ] 纳入30例晚期卵巢癌患者的开放标签、多中心研究(NCT04417192)的初步结果显示,奥拉帕利单药组(10例)在同源重组缺陷(HRD)阳性卵巢癌患者的新辅助治疗中有一定的疗效和耐受性,客观缓解率(objective remission rate,ORR)为50%,≥3级AE发生率为40%。意大利的一项TC方案联合奥拉帕利作为卵巢癌新辅助治疗方案的Ⅱ期临床试验(即NUVOLA研究;NCT04261465)招募了无法行满意肿瘤细胞减灭术的晚期卵巢癌患者,受试者将接受每周TC方案静脉化疗联合奥拉帕利口服治疗,4周后行IDS,评估联合奥拉帕利是否获益,目前尚未公布研究数据 [ 30 ] 。我国发起了一项尼拉帕利单药作为HRD阳性晚期卵巢癌新辅助治疗的前瞻性Ⅱ期临床研究(即NANT研究;NCT04507841),目前有67例患者接受了尼拉帕利单药新辅助治疗,结果显示,30例部分缓解,12例疾病稳定,ORR为62.5%;40例接受IDS,R0切除率为80.0%,≥3级AE发生率为61.2%,血液学副反应最常见 [ 31 ] 。最近,一项国际性的评估尼拉帕利在卵巢癌新辅助治疗中疗效的Ⅱ期临床试验(即OPAL-C研究;NCT03574779)也在进行中,该研究比较了尼拉帕利作为新辅助治疗方案与标准NACT方案(铂类药物+紫杉醇方案)在晚期HRD阳性卵巢癌患者中的疗效,评估尼拉帕利对于PFS时间、OS时间、R0切除率是否获益,该研究仍在进行,尚未公布结果 [ 32 ] 。见 表2 。

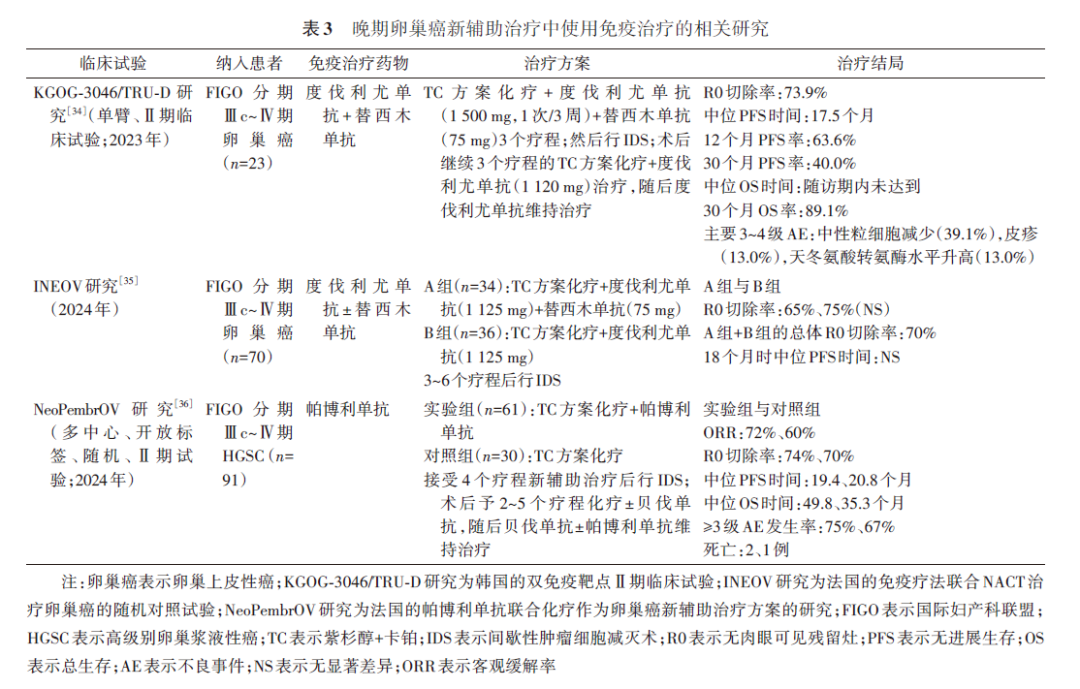
PARPi在晚期卵巢癌新辅助治疗中的应用仍处于临床探索阶段,PARPi具有一定的有效性和安全性,但其最终对PFS时间和OS时间的影响仍未明确。3.免疫治疗:恶性肿瘤的晚期,免疫反应受到肿瘤微环境和多种免疫耐受机制[如调节性T淋巴细胞(Treg)和髓源性抑制细胞(MDSC)]的抑制。抗肿瘤药物,包括常规化疗药物和靶向药物可以诱发肿瘤特异性免疫能力,刺激免疫系统识别和破坏肿瘤细胞,该机制通常称为免疫原性细胞死亡。最近的动物研究显示,ID8卵巢癌细胞(C57BL/6小鼠卵巢癌的克隆)可能会通过细胞程序性死亡受体1(programmed cell death protein 1,PD-1)/细胞程序性死亡配体1(programmed cell death ligand 1,PD-L1)通路逃避免疫攻击,当免疫治疗与化疗、放疗、靶向治疗或其他药物联合使用时,阻断PD-1/PD-L1通路可在卵巢癌中产生协同抗肿瘤反应 [ 33 ] 。韩国的双免疫靶点Ⅱ期临床试验(即KGOG-3046/TRU-D研究;NCT03899610)开启了双免疫治疗联合化疗作为晚期卵巢癌的新辅助治疗策略 [ 34 ] 。该研究采用标准的TC方案联合抗PD-L1单抗——度伐利尤单抗和抗细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)单抗——替西木单抗,经过3个疗程的新辅助治疗后行IDS,R0切除率达73.9%,ORR为95.7%,中位PFS时间17.5个月,中位OS时间随访期内未达到;主要3~4级AE为中性粒细胞减少(39.1%)、皮疹(13.0%)、天冬氨酸转氨酶水平升高(13.0%),23例患者中2例因4级皮疹和肺炎而终止研究,研究期间无手术相关死亡病例。法国的免疫疗法联合NACT治疗卵巢癌(INEOV)的RCT研究(NCT03249142)显示,TC方案+度伐利尤单抗联合替西木单抗与不联合替西木单抗患者的R0切除率比较无显著差异(65%、75%),但加入免疫治疗后患者的总体R0切除率有所提高(70%);18个月时,两组PFS时间无显著差异 [ 35 ] 。该研究也初步表明,NACT联合免疫疗法可以提高R0切除率,延长PFS时间,但是双免疫靶点是否一定比单免疫靶点效果好还有待进一步验证。法国的帕博利单抗(pembrolizumab)联合化疗作为卵巢癌新辅助治疗方案(NeoPembrOV)研究(NCT03275506)是一项多中心、开放标签、随机、Ⅱ期临床研究,旨在探索TC方案联合帕博利单抗或不联合帕博利单抗(分别为实验组和对照组)作为晚期高级别卵巢浆液性癌患者新辅助治疗方案能否提高IDS的R0切除率,研究结果初步显示,实验组R0切除率为74%,对照组为70%,在统计学上优于预先设定的假设;两组的ORR分别为72%、60%,实验组明显高于对照组;中位PFS时间分别为19.4、20.8个月,两者有显著差异;中位OS时间分别为49.8、35.3个月,实验组明显优于对照组;≥3级AE发生率分别为75%、67%,最终因较高的AE而终止研究 [ 36 ] 。NeoPembrOV研究无论是实验组还是对照组,AE发生率均较高,可能与用药前的预处理不足有关,也可能因样本量小,存在样本选择偏倚,NeoPembrOV研究再次警醒临床工作者,化疗联合免疫治疗时需更加注意防范相关AE的发生。见 表3 。
HRD阳性肿瘤具有较高的免疫原性,免疫检查点抑制剂(immune checkpoint inhibitors,ICI)可能对HRD阳性卵巢癌患者有效,PARPi与ICI联合治疗可能是一种有前景的治疗策略 [ 37 ] 。PARPi可通过激活干扰素基因刺激因子(STING)通路刺激免疫反应,无论BRCA基因状态如何,PARPi均可增强ICI在卵巢癌中的治疗效果 [ 38 ] 。一项评估奥拉帕利联合或不联合帕博利单抗作为HRD阳性Ⅲ~Ⅳ期卵巢癌患者新辅助治疗方案的疗效和安全性的队列研究正在进行中,有望为PARPi联合免疫治疗作为晚期卵巢癌新辅助治疗带来临床证据 [ 29 ] 。根据目前的小规模研究结果,免疫治疗联合TC方案化疗作为晚期卵巢癌新辅助治疗方案的ORR为72%,中位PFS时间为17.5~19.4个月,中位OS时间为49.8个月,≥3级AE发生率为75%,主要是血液学及免疫相关AE。这些研究的样本量偏小且多为单臂研究,免疫治疗在晚期卵巢癌新辅助治疗中的有效性仍需进一步验证。应用单药免疫治疗还是联合免疫治疗,国内外尚无证据及推荐 [ 39 ] 。了解肿瘤的免疫生物学特性,建立最佳治疗组合仍然是免疫疗法在卵巢癌未来应用中的关键挑战。4. HIPEC:HIPEC是一种治疗肿瘤的技术,通过将加热的化疗药物溶液灌注到整个腹膜间隙以杀灭肿瘤细胞达到缩小肿瘤的目的,其原理包括增加化疗药物在腹腔的浓度,增强化疗药物在腹膜表面的渗透作用,通过增加药物摄取和DNA加合物的形成而增强化疗药物的细胞毒性,通过抑制肿瘤细胞DNA修复增强肿瘤细胞对化疗药物的敏感性 [ 40 ] 。吴妙芳等 [ 41 ] 在2020年发表的一项回顾性研究分析了HIPEC在晚期卵巢癌IDS前应用的有效性,HIPEC+2个疗程NACT后行IDS,中位PFS时间为16个月,中位OS时间随访期内未达到,3级AE发生率14%,主要为中性粒细胞减少和呕吐,无4级AE发生。该课题组后续在2022年的研究中再次肯定了HIPEC的有效性,该研究共纳入127例晚期卵巢癌患者,其中81例接受HIPEC+NACT作为新辅助治疗方案,HIPEC+NACT组患者的化疗反应率明显高于NACT组(43.5%、23.5%; P=0.019),与NACT组相比,HIPEC+NACT组患者的PFS时间显著延长(分别为16、22个月; P<0.001),HIPEC被认为是影响PFS时间的独立因素( P<0.001);但HIPEC+NACT组与NACT组的R0切除率(84.8%、76.5%; P=0.269)和OS时间(51、44个月; P=0.062)分别比较均无显著差异,两组患者的3~4级AE发生率(26.1%和19.8%)比较,差异也无统计学意义( P=0.408) [ 42 ] 。提示,HIPEC联合NACT作为新辅助治疗方案是安全、有效的,可改善R0切除率和患者的PFS时间,但这些研究结果来源于同一中心的回顾性研究,需更多的临床数据来验证。3个关于HIPEC的RCT研究表明,HIPEC可以改善晚期卵巢癌患者的PFS时间和OS时间,但HIPEC均是在IDS术后立即予以施行而非术前。其中最新和最大规模的临床研究是荷兰的开放标签Ⅲ期RCT研究(即M06OVH-OVHIPEC研究; n=245),IDS组和IDS+HIPEC组患者的中位无病生存时间分别为10.7和14.2个月,中位OS时间分别为33.9和45.7个月,两组≥3级AE发生率比较无显著差异 [ 43 ] 。2023年该研究组更新了结果,IDS组和IDS+HIPEC组中位PFS时间分别为10.7、14.3个月( HR=0.63,95% CI为0.48~0.83, P=0.001);中位OS时间分别为33.3、44.9个月( HR=0.70,95% CI为0.53~0.92, P=0.011) [ 44 ] 。这些更新的生存结果证实了IDS+HIPEC在原发性晚期卵巢癌患者中的长期生存获益。韩国的HIPEC前瞻性研究收集2010年3月2日至2016年1月22日Ⅲ~Ⅳ期卵巢癌患者184例,随机(1∶1)分为HIPEC和非HIPEC组,在PDS亚组中,PFS时间和OS时间均无显著性差异;而在IDS亚组中,两组的PFS时间和OS时间均有显著差异 [ 45 ] 。另一项韩国妇科肿瘤组(Korean Gynecologic Oncology Group,KGOG)-3042研究中观察到,IDS+HIPEC能够显著改善Ⅲ~Ⅳ期卵巢癌患者的预后(IDS+HIPEC组和IDS组的中位PFS时间分别为22.9、14.2个月, P=0.005;中位OS时间分别为随访期内未达到、53个月, P=0.002),两组术后并发症发生率相似 [ 46 ] 。这些研究均表明在原发性晚期卵巢癌患者中,HIPEC无论是在IDS前还是在IDS后立即予以施行均安全、有效。HIPEC在IDS前患者的中位PFS时间为16个月,中位OS时间随访期内未达到,3级AE发生率为14%;HIPEC在IDS前后均施行患者的R0切除率为84.8%,中位PFS时间为22个月,中位OS时间为51个月,3~4级AE发生率为26.1%;HIPEC在IDS后立即予以施行患者的中位PFS时间为14.3~22.9个月,中位OS时间为22.9~>53.0个月,3~4级AE发生率为2.8%~27.0%。但在IDS前应用HIPEC仅有我国的两项回顾性研究,是否获益还需更高级别的前瞻性研究验证。NCCN指南目前没有限制HIPEC的使用。我国的妇科肿瘤腹腔热灌注治疗临床药物应用专家共识(2024年版) [ 47 ] 建议IDS后进行HIPEC(时间为60~90 min,温度为41~43 ℃)。晚期卵巢癌的NACT目前存在争议,部分学者认为,含铂NACT可能会诱导铂耐药,尤其是超过3个疗程时,但毋庸置疑的是NACT为不能行PDS的患者带来了手术希望,在降低手术风险的同时可获得不亚于PDS的生存结局。建议晚期卵巢癌患者通过Suidan评分、Fagotti评分以及Mayo分类算法等进行分流,对无法行满意PDS患者行新辅助治疗,含铂NACT作为首选,建议3~4个疗程。靶向治疗、PARPi治疗、免疫治疗作为卵巢癌新辅助治疗阶段的探索,根据目前的临床研究结果,单药应用的疗效有限,建议联合化疗或相互联合应用,但需注意其副反应,尤其是免疫治疗时。双免疫靶点治疗是否优于单免疫靶点治疗有待进一步验证。IDS后立即予HIPEC的疗效明确,可显著改善PFS率和OS率,建议IDS后立即予HIPEC治疗;根据仅有的两项回顾性研究,新辅助治疗阶段(在IDS前)予HIPEC可能会延长PFS时间,但对R0切除率及OS时间的影响尚未明确,建议开展相关前瞻性研究,明确其疗效后再开展临床应用。随着研究的深入,需要进一步思考,经过PARPi新辅助治疗后一线维持治疗再用PARPi是否有影响?HIPEC只有在原发性卵巢癌且存在NACT情况下才获益,在PDS或在复发性卵巢癌中使用HIPEC不存在有统计学意义的生存获益,为什么?其作用机制是什么?使用这些治疗后的卵巢癌复发模式是否会发生改变?靶向治疗、PARPi治疗、免疫治疗、HIPEC等临床试验,为卵巢癌新辅助治疗新模式的应用提供了真实世界数据,为后续改进新模式用药方案提供了理论依据。但目前相关研究较少,样本量不大,且大多处于探索阶段,结论尚未明确,其实践仍需更多的高质量RCT和更充分的循证医学证据来支持。
利益冲突 所有作者声明无利益冲突