转载:SOGC临床实践指南:子宫腺肌症的诊断与治疗
加拿大妇产科协会(SOGC)近期发布了“子宫腺肌症的诊断与治疗”的临床实践指南,介绍了目前子宫腺肌症的循证诊断和治疗方法:
关键信息
1.子宫腺肌症主要影响育龄期的女性;
2.子宫腺肌症可通过经阴道的超声检查进行诊断;
3.对于有症状的子宫腺肌症患者,可通过内科、介入和手术等方式保留生育功能。
(文末附推荐总结)
前言
子宫腺肌症是一种良性的妇科疾病,以子宫内膜腺体和间质侵入肌层为特征,周围伴有子宫肌层的增生[1]。子宫腺肌症传统上是通过全子宫切除术后的组织学来诊断。然而,经阴道超声(TVUS)和磁共振(MRI)等影像学的进展改变了临床子宫腺肌症的临床现状,使其能被早期识别。由此产生一个很重要的认知,即子宫腺肌症会引起年轻患者产生症状,可能需要终身治疗管理[1]。超声检测发现20.9%-34%的育龄女性患有子宫腺肌症[2-4]。虽然这些患者中有30%无症状,但其余的患者可能经历各种形式的盆腔疼痛(痛经、性交痛、慢性盆腔疼痛)、异常子宫出血(AUB)、不孕症、复发性流产和不良妊娠结局[1]。全子宫切除术是子宫腺肌症的最终治疗方法。然而,考虑到子宫腺肌症患者就诊时年龄较小以及可能对生育能力产生影响,人们对保守性的治疗越来越关注。本指南旨在探讨目前子宫腺肌症的诊断和管理。
子宫腺肌症相关的临床症状
子宫腺肌症常与其他妇科疾病同时发生,如子宫肌瘤和子宫内膜异位症,并可能引起患者的整体临床症状[1]。例如,对于患有子宫肌瘤或者因子宫内膜异位症引起经期大出血的患者,子宫腺肌症可能引起盆腔疼痛。子宫腺肌症中疼痛的发生率为50%-90%,并且子宫腺肌症的超声特征数量与痛经之间存在线性关系[1,5]。超声提示患有子宫腺肌症的女性中,疼痛评分显著升高(8.38vs7.61,P=0.003)。同样的,超声提示患有子宫腺肌症的女性中,经期大出血的发生率更高(18.9%vs2.9%),并且每增加一个子宫腺肌症的超声特征,失血量增加22%[1,6]。24.4%有不孕症、流产或辅助生殖反复胚胎植入失败病史的患者中超声检查提示子宫腺肌症的影像学征象[4]。子宫腺肌症与不良妊娠结局相关,包括早产(比值比OR=2.65)、子痫前期(OR=4.32)、妊娠高血压(OR=3.11)、剖宫产(OR=2.48)、胎位异常(OR=3.05)、小于胎龄儿(OR=2.86)、宫内生长受限(OR=3.40)和产后出血(OR=2.90)风险增加[7]。
子宫腺肌症的诊断
子宫腺肌症的组织学诊断标准并不标准化。组织学上的定义因肌层穿透深度和肌层受累的比例而不同,并且诊断可能受子宫切片范围的差异和和观察者间差异的影响[8]。经阴道超声(TVUS)和磁共振成像(MRI)对子宫腺肌症的影像学诊断越来越普遍。但是,与组织学诊断相似,TVUS和MRI对于子宫腺肌症诊断标准也没有标准化,这将继续使得专有名词、发病率和诊断的不一致。形态学子宫超声评估(MUSA)小组提出了一种基于超声特征的子宫腺肌症的TVUS分类系统,并将其扩展到描述疾病的范围、程度和症状的严重程度[9]。他们试图创建一个报告和诊断子宫腺肌症的标准化系统,应用于临床实践和未来的研究。同样,人们也在尝试开发临床预测模型协助诊断子宫腺肌症和指导临床治疗。其中一个模型发现了9个预测因子,包括症状和超声特征。在子宫腺肌症的诊断中,敏感性为85%,特异性为78%[10]。目前正在努力验证这一模型,并建立一个可在临床应用中使用的移动平台。
经阴道超声
二维(2D)TVUS是诊断子宫腺肌症最常用的影像学方法,其敏感性高达72%-82%,特异性高达81%-85%[11-12]。MUSA小组建议,在研究子宫腺肌症时,应评估以下7个项目:
(1)存在子宫腺肌症的典型特征(方框1和图1);
(2)子宫腺肌症的位置;
(3)分化(局灶性或弥漫性);
(4)囊性或非囊性病变;
(5)子宫肌层受累程度(交界区、中肌层和外肌层);
(6)病变的程度;
(7)最大病灶的大小和或影响区域[9]。

方框1
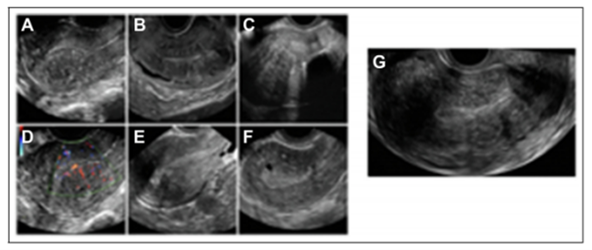
图1.A)子宫后肌层不对称增厚;B)交界区不规则增厚,有异位子宫内膜小回声区;C)扇形阴影,有原位宫内节育器;D)病灶区血管分布,血管垂直于子宫内膜;E)子宫内膜下芽状回声;F)前子宫腺肌症伴肌层囊性病变;G)子宫球形增大。
其他较少报道的子宫腺肌症的发现包括问号征(子宫体由前朝着宫颈的方向向后弯曲)和TVUS子宫压痛,这两个特征对子宫腺肌症诊断的敏感性和特异性分别为41%和96%[13]。子宫腺肌瘤是局灶性子宫腺肌症的一个亚群,常伴有周围的子宫肌层肥大[9]。尽管人们努力使诊断分析标准化,但关于子宫腺肌症的报告仍有很大的异质性。此外,目前尚不清楚子宫腺肌症的哪些特征具有最重要的临床意义,以及有多少特征需要用于临床诊断。
本文研究了子宫腺肌症的TVUS特征与临床症状之间的关系。二维TVUS发现高达83%的弥漫性子宫腺肌症患者有子宫腺肌症的症状[3]。其他研究表明,症状发生率和/或严重程度随着TVUS上子宫腺肌症特征的增加而增加[3,5,6,14]。有4个或更多的特征与经期大出血或疼痛更相关[5,6]。此外,在二维TVUS上,子宫内膜异位症患者有可能出现1个及以上的子宫腺肌症的特征[15]。考虑到这两种疾病的病因可能有一些共性,对子宫内膜异位症行影像学检查的患者应考虑对子宫腺肌症的诊断,反之亦然。
三维(3D)TVUS对连接区的可视化程度更高。一项研究表明,用3D TVUS联合2D TVUS提高了特异性(81%vs64%),但对敏感性没有影响(85%vs84%)。3D TVUS子宫腺肌症的特征包括:
(1)一个界限不明确、不规则、中断的连接区;
(2)交界区厚度>8mm;
(3)交界区最大和最小厚度差异>4mm。
因为子宫腺肌症被认为是由子宫内膜侵入交界区,因此3D TVUS可能有助于识别早期疾病。
磁共振成像
MRI在子宫腺肌症的诊断中敏感性是77%,特异性是89%。它对操作技能的依赖性低于TVUS[11]。MRI可能更有利于区分子宫腺肌瘤和子宫肌瘤[18]。然而,子宫腺肌症的MRI诊断也没有标准化的报告和诊断标准的标准化。例如,许多研究定义≥12mm为连接区增厚,而其他研究则使用低至9mm的截断值[14]。此外,大多数研究者认为T2加权成像对交界区解剖和子宫腺肌瘤的评估是最适合的,但也有一些人认为T1加权成像是更佳[11]。无论如何,子宫腺肌症的T1和T2加权成像均报道了子宫腺肌症的多种特征;同样,对于诊断上需要考虑哪些特征还没有达成共识。
子宫腺肌症的MRI特征可以是间接的,也可以是直接的。间接特征包括交界区厚度>12mm(敏感性是72%,特异性是86%)、交界区差异>5mm(敏感性是58%,特异性是83%)、交界区与子宫肌层厚度的比值>40%(敏感性是63%,特异性是79%)和子宫增大(敏感性是43%,特异性是88%)[19]。直接特征包括肌层囊性病变(敏感性是60%,特异性是96%),其中偶尔可能含有血液成分和含铁血黄素引起的T1高信号[20];子宫腺肌瘤(子宫肌层肿物不累及子宫浆膜或交界区);浆膜外型子宫腺肌症(累及浆膜但不涉及交界区)[11]。浆膜外型子宫腺肌症在后肌层明显比前肌层更常见,可能与子宫内膜异位症有关[11]。
MRI有几个缺点。首先,子宫腺肌症的评估不应该在月经期和早期增生期进行,由于这个时期子宫肌层信号强度降低,可能导致交界区伪增宽[20]。第二,子宫收缩可导致交界区的假性增宽[20]。第三,20%到30%的育龄妇女无法测量交界区[11]。第四,MRI子宫腺肌症的具体特征与临床症状和症状严重程度的研究有限[19]。最后一点是,MRI比TVUS费用高,而且通常需要更长的等待时间。由于这些问题,MRI是子宫腺肌症诊断的二线影像学检查,通常用于在TVUS评估不确定或可能存在严重的盆腔病理疾病需要手术治疗时。
组织取样技术
保留生育功能的组织取样技术也已被研究用于诊断子宫腺肌症。这些技术包括宫腔镜下子宫活检、腹腔镜下的子宫活检和超声引导下的经腹或经阴道子宫肌层细针穿刺活检。一项系统回顾指出,在大多数情况下,这些技术的敏感性低于非侵入性的成像检查,敏感性为22.2%-97.8%,并取决于活检的次数、活检位置和活检技术[21]。然而,特异性为78.5%-100%,因此,组织取样进行子宫腺肌症的确诊是可能的。腹腔镜下14号细胞细针穿刺子宫活检具有最高的敏感性(97.8%)和特异性(100%)[22]。在因其他保留生育能力的原因而接受腹腔镜手术的患者中,它可作为有用的确诊方式。目前,非侵入性成像方式仍然是诊断子宫腺肌症的一线方法。在对确诊有益的情况下可以使用直接组织取样技术。
子宫腺肌症的内科管理
随着人们认识到子宫腺肌症是一种影响那些想要保留生育功能的年轻患者的疾病时,内科管理变得越来越重要。虽然还没有药物被专门批准用于治疗子宫腺肌症。但是近期的研究表明目前用于治疗经期大出血、痛经和盆腔疼痛的药物可以很好的控制上述症状。由于子宫腺肌症常与子宫内膜异位症和子宫肌瘤共存,这些药物可能同时解决多种妇科疾病。
非激素类药物
成熟的非激素选择包括治疗痛经和经期大出血的非甾体抗炎药,以及治疗经期大出血的药物-氨甲环酸[23]。但是这两种药物都没有在子宫腺肌症患者中进行过专门的研究。
激素类药物
孕激素
孕激素具有抗增殖和抗炎作用,能引起子宫内膜蜕膜化和萎缩。相关研究包括局部给药和口服用药,特别是在子宫腺肌症中。左炔诺孕酮宫内缓释系统(LNG-IUS)是治疗有症状的子宫腺肌症最好的药物。一项随机对照试验(RCT)比较了75例出现经期大出血和/或痛经症状,并且经影像学证实为子宫腺肌症的患者使用LNG-IUS和全子宫切除术,发现接受LNG-IUS治疗的患者血红蛋白水平相对改善,生活质量评分更高[24]。在第二项随机对照试验中,纳入62例超声证实的子宫腺肌症伴有疼痛的患者(伴或不伴出血),LNG-IUS和低剂量复方口服避孕药(COC)治疗6个月时能有效减轻疼痛、减少出血时间和缩小子宫体积;然而,LNG-IUS在所有指标上都优于COC[25]。一个纳入10项前瞻性研究的meta分析(n=551)指出,LNG-IUS在3年内能降低了疼痛评分、出血和子宫体积[26]。纵向研究(5-10年)结果显示其能持续控制症状,这表明治疗子宫腺肌症时,LNG-IUS是一种可接受和可行的长期管理策略[27,28]。多个研究报道了LNG-IUS的3年和5年的长期累积留存率分别为57.5%和56.2%,以及LNG-IUS自行脱落与子宫增大和大出血有关[29,30]。在LNG-IUS治疗前使用促性腺激素释放激素激动剂(GnRH-a)进行预处理,可降低其脱落的风险,在适当的情况下可考虑使用[27,29]。
治疗子宫腺肌症引起的痛经最好的口服孕激素是地诺孕素(剂量为每天2毫克)。一项多中心随机对照试验纳入67例经影像学证实的子宫腺肌症伴有痛经的患者,该研究发现使用地诺孕素16周时,通过3分言语描述疼痛量表比较地诺孕素组疼痛评分下降幅度显著高于安慰剂组(3.8vs1.4;P<0.001)[30]。另一个随机对照试验纳入110名经影像学证实的子宫腺肌症伴痛经(伴或不伴月经过多)的患者,该研究发现在治疗6个月时,地诺孕素在降低疼痛评分(视觉模拟评分(VAS) 3.21±1.18vs4.92±1.22;P=0.000)和月经出血模式显著优于复方口服避孕药,并且只有地诺孕素能减少子宫体积和子宫动脉血流量。然而,地诺孕素的副作用更多,包括突破性出血(68.8%vs4.1%,P<0.0000)[31]。130例子宫腺肌症接受地诺孕素患者的长期随访结果表明在24周和52周时疼痛持续缓解[31]。虽然地诺孕素疗效较好,但突破性出血是一种常见的副作用,可能引起治疗停止[32,33]。
另一种口服孕激素是醋酸炔诺酮,在一个包含28例患者的小型回顾性研究中证明它能改善痛经和出血。在这项研究中,该药物采用循环方案给药(剂量为每日5毫克,服药3周/停药1周),以减少突破性出血的发生[34]。
复方口服避孕药
复方口服避孕药(COCs)是一种内科治疗方式,由于其使用普遍和用途多被患者和医生广泛接受。此外,周期性或持续性使用COC是治疗异常子宫出血和/或痛经的有效方式。COCs可引起子宫内膜蜕膜化和萎缩,改善经期大出血和痛经的症状,但是持续使用可导致闭经[25]。虽然使LNG-IUS的患疼痛减轻程度高于使用COCs的患者(LNG-IUS组为6.23±0.67-1.68±1.25;COC组6.55±0.68-3.90±0.54);然而,COCs在减轻疼痛方面仍然有效[25]。同样的,使用LNG-IUS后患者每月平均出血天数减少更多(使用前:9.81±1.82天,使用LNG-IUS6个月后:2.63±2.13天);然而,使用COCs的患者也能显著减少出血天数(从9.97±1.52天减少到5.52±1.00天)[25]。
与地诺孕素相比,COCs使用6个月时,出血天数较少但仍有显著性变化(地诺孕素从9.55±2.17减少到5.54±2.47;COCs从10.05±1.94减少到7.80±1.38)[31]。同样的,COCs使用6个月时疼痛评分下降较低但仍有显著性变化(地诺孕素从(6.27±1.21减少到3.21±1.18;COCs从6.11±1.13减少到4.92±1.22)[31]。因此,COCs对疼痛评分和出血的总体影响较小,但它们在减少疼痛和重出血方面仍然有效,可以作为有症状性子宫腺肌症患者的另一种治疗方案。在上述研究中,COCs按照服药3周/停药1周的方案给药。但是,作者认为持续用药也将产生同样的效果或更有效。
促性腺激素-释放激素类似物(GnRH)
GnRH-a能够完全抑制中枢性促性腺激素的分泌,并诱导一种低雌激素、抗增殖和促凋亡的状态[35]。虽然GnRH-a对子宫内膜异位症和子宫肌瘤有效,但对子宫腺肌症的疗效尚未得到很好的研究。一项回顾性队列研究纳入52例经磁共振诊断为子宫腺肌症患者,使用GnRH-a(亮丙瑞林或戈舍瑞林)、低剂量COC或地诺孕素治疗,研究发现在治疗16周后只有GnRH-a能显著减少子宫体积[36]。一项大型多中心前瞻性研究纳入465名有症状的子宫腺肌症患者,所有患者行曲普瑞林治疗3-6个周期(周期/28天),结果表明大出血、痛经和盆腔疼痛有显著改善,并且只有14%的患者出现潮热[37]。由于停止治疗后症状可能会复发,因此需要长期使用GnRH-a或其他激素药物治疗才能持续获益[38]。为了减轻长期使用GnRH-a引起低雌激素的副作用,建议反向补充激素治疗[39]。另一种策略是使用较低剂量的药物。一项小型回顾性研究显示,12例患者长期低剂量使用醋酸布舍瑞林治疗(所谓的“后退”疗法),发现盆腔疼痛评分降低,血管舒缩症状比之前使用完全剂量的GnRH-a治疗时更轻,并且骨密度只有轻微降低[40]。
GnRH拮抗剂可剂量依赖性的抑制垂体-性腺轴,并已在子宫内膜异位症和子宫平滑肌瘤中进行相关研究[41]。病例报告提示GnRH拮抗剂用于子宫腺肌症的治疗是有希望的,研究结果表明在严重的子宫腺肌症患者中,它能减少病变的大小和改善患者的生活质量。
达那唑
达那唑是17α-甲基睾酮的衍生物,它可以抑制促黄体生成素(LH)的高峰,并增加游离睾酮水平。虽然体外研究表明,达那唑直接影响子宫腺肌症的病变,但全身给药受到强大的雄激素副作用的限制[39]。新的给药系统,例如达那唑涂层的宫内节育器、宫颈注射或阴道栓剂,在子宫腺肌症患者的出血和疼痛方面具有良好的疗效,同时最大限度减少副作用[39]。例如,一项回顾性研究显示,66例痛经和/或性交痛合并AUB患者,每日给予阴道达那唑栓剂治疗6个月,随后连续或周期性给药18个月,能有效改善疼痛、出血、子宫大小和心理健康[42]。
其他治疗方法
选择性孕酮受体调节剂和芳香化酶抑制剂也可以改善子宫腺肌症的症状。在一项小型随机对照试验中,40例AUB(伴或不伴疼痛)合并子宫腺肌症患者接受醋酸乌利司他与安慰剂治疗12周,出血和疼痛评分显著降低。然而,在治疗停止后,症状再次复发[43]。同样的,一项随机对照试验纳入32例有症状的子宫腺肌症患者,来曲唑治疗12周后在减轻症状和减小子宫体积方面与GnRH激动剂一样有效[44]。丙戊酸和抗血小板治疗被认为是子宫腺肌症的新疗法[39]。
子宫腺肌症的介入治疗
子宫动脉栓塞
子宫动脉栓塞(UAE)是一种在门诊实行的微创治疗方法,最初旨在减少出血和肌瘤的体积。采用透视引导下的血管造影术,将合成药物通过导管注射到子宫动脉中,导致靶组织缺血[45]。在过去的20年里,相关研究支持在已经完成生育要求并且有症状的子宫腺肌症患者使用UAE。2017年发表的一项系统综述和meta分析研究了30项观察性试验的结果,共纳入1000多名接受UAE治疗的子宫腺肌症患者。研究结果显示,对于经期大出血(84.3%-91.3%)、痛经(86.1%-91.1%)和大病灶引起的症状(74.8%-87.7%),短期(<12个月)和长期(>12个月)来看均有改善。短期和长期随访结果提示,持续或复发性患者的子宫切除术率分别为4%和14.2%[46]。目前,一项比较UAE和子宫切除术作为子宫腺肌症的主要治疗选择的随机对照试验正在进行中[47]。
尽管研究结果相互矛盾,但UAE对子宫腺肌症患者的预后可能因具体特征而不同。血管增生、局灶性腺肌症病灶的患者似乎对治疗反应更好[48]。另一方面,治疗前较厚连接区可能预示着治疗失败[49]。对这些特征的不断认识将用于更精准患者选择和个体化的治疗。评估UAE在未来有生育要求的患者中的安全性亟需更多的研究。
微创热消融术
早期的研究结果表明在有症状的子宫腺肌瘤患者中应用保留子宫的热消融手术的前景,包括高强度聚焦超声(HIFU),射频消融(RFA)和经皮微波消融术(PMWA)(表1)。然而,仍有许多问题仍未得到解答。目前,HIFU、RFA和PMWA治疗子宫腺肌症的能量设置来参考的是它们在子宫肌瘤中的治疗[45]。然而,子宫腺肌症在组织学上与子宫肌瘤是很不一样的。子宫腺肌症的细胞数量和血管分布增加,并且边界没有那么明确,导致组织对热能的反应不同[45]。为了最大限度的提高治疗效果,减少热损伤,优先考虑建立子宫腺肌症的参数。此外,目前还不清楚在如此强烈热反应后子宫肌层是如何修复的,或者它是否会导致一些并发症,如子宫粘连或破裂。由于缺乏关于生育力和妊娠相关研究的数据,因此,对于尚未完成生育要求的患者,必须谨慎使用这些技术[45]。虽然一些meta分析的初步结果令人鼓舞,但纳入研究的偏倚风险和异质性高,使得很难对热消融技术在子宫腺肌症治疗中的作用得出准确的结论。目前还没有随机对照试验或比较研究,也没有强有力的长期数据表明患者在接受上述的热消融手术后需要反复治疗。
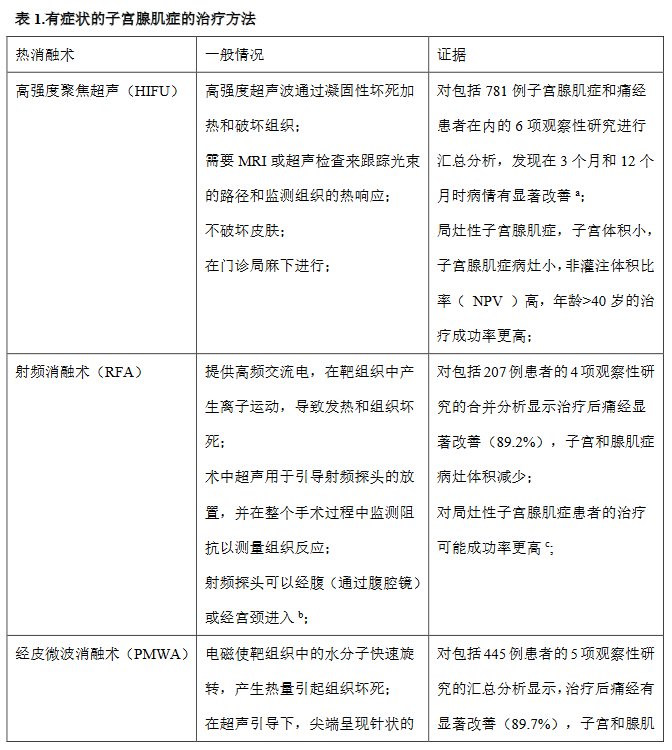

表1
手术治疗方案
子宫内膜消融术
子宫内膜消融术(EA)是一种微创治疗方式,与全子宫切除术相比,其恢复速度更快,严重并发症的发生率更低。对于那些已经完成生育要求,但想要保留子宫的AUB患者来说,这是一个很有吸引力的治疗方法[45]。早期研究表明,子宫腺肌症患者行EA治疗后与持续性或复发性出血、痛经以及新发的盆腔疼痛有关[45]。然而,一项针对43例行全面EA治疗的子宫腺肌症患者进行的前瞻性研究提示93%的患者在治疗6个月后出血明显减少,并且67.4%的患者在3年内持续有效。同样的,在治疗6个月和3年时,痛经的改善率分别为60.6%和51.5%[50]。在3年的随访期间,由于症状持续或复发而导致的全子宫切除术率为18%。因此,对于没有盆腔疼痛的围绝经期妇女,它仍然是一个可接受的治疗选择,但对年轻患者和伴有痛经的患者治疗方案应该是由差别的,以反映这项前瞻性试验的结果。一些研究者建议在EA治疗后植入LNG-IUS,以增强治疗的效果[51]。未来需要更多的研究来证实这些发现,并评估其他类型的EA的结局。
保留子宫的子宫腺肌症手术
子宫腺肌症病灶切除的手术已经越来越完善,并且发展出多种复杂的术式。这些切除和重建技术包括Osada教授的“三瓣法”子宫腺肌瘤切除术和Fujishita教授的H形切口[45]。主要的手术原则包括切除病变组织,同时保留子宫肌层的强度和完整性。正如子宫肌瘤切除术一样,重要的是要避免破坏子宫内膜腔,尽量减少浆膜损伤,保持输卵管的完整性,并进行多层缝合子宫肌层。
手术通常用于治疗那些伴有痛经和/或AUB症状,希望保留子宫但是药物治疗失败或对于药物治疗有禁忌证的患者。目前还没有强有力的数据支持仅在不孕症的情况下进行这些手术,因为这种手术对妊娠和生育力的影响是复杂的。子宫腺肌瘤切除术是十分具有挑战性的,因为缺乏清晰的组织平面和交界区不规则。采用腹腔镜、机器人和开腹手术方式切除局限性和弥漫性的子宫腺肌瘤病灶并且重建子宫。然而,关于不同手术路径的围手术期和长期预后缺乏有效的数据支持。有关生活质量、痛经和异常出血的数据仅限于病例报告。虽然这些病例都报道症状表有改善,但是无论哪种手术路径,它们的异质性太强而不能说明哪种手术路径优于另一种手术路径[45]。虽然局灶性子宫腺肌症适合微创手术,但许多专家认为,在弥漫性子宫腺肌症中,开腹手术提供的触觉反馈会获得更精确的手术操作和更强的肌层修复[52]。
围手术期并发症包括术中出血、输血和紧急全子宫切除术。考虑到手术可能存在大出血,贫血(血红蛋白<120g/L)患者术前必须纠正贫血(例如术前抑制月经和补充铁制剂),以降低发病率和死亡率[45,53]。
因为这种治疗方案通常适用于那些尚未完成生育要求的患者,有关手术对生育能力和妊娠结局的潜在影响的咨询是至关重要的。相关风险包括紧急全子宫切除术、发生腹腔和宫腔粘(阿舍曼综合征)和植入性胎盘谱系疾病[52]。最重要的是,这些患者在妊娠中期和晚期发生子宫破裂的风险显著增加,在文献中,子宫破裂的发生率为0.8%-6%[45,52]。导致子宫破裂的危险因素包括病灶切除的范围和随之发生的子宫肌层缺损的大小、子宫重建技术、术后感染或血肿,以及外科医生的手术技术[52]。此外,电外科设备被认为会影响伤口愈合和术后子宫肌层的强度和完整性,使得一些专家支持冷刀技术(例如手术刀和剪刀)[52]。没有有效的证据表明手术到妊娠的间隔时间影响子宫腺肌瘤切除术后子宫破裂的发生率。鉴于以上这些风险,许多专家建议行产前剖宫产,特别是在大范围的病变切除术后[45]。
全子宫切除术
虽然全子宫切除术是有症状的子宫腺肌症的最终治疗方法,但关于术后生活质量的研究仍然缺乏[45]。有症状的子宫腺肌症患者行全子宫切除术的适应证包括保留子宫的治疗方案失败或者存在禁忌证,以及患者的选择。如果患者选择在全子宫切除术时保留子宫颈,应仔细告知其持续的周期性出血和盆腔疼痛的可能性[45,53]。对于合适的患者可以行腹腔镜下全子宫切除术,因为该手术被认为是标准的手术方案[52]。2019年SOGC临床实践指南No.377:妇科良性疾病的子宫切除术的适应证中详细概述了全子宫切除术的其他推荐[53]。
一般来说,当有痛经或盆腔疼痛的子宫腺肌症患者考虑行手术治疗时,应高度怀疑合并子宫内膜异位症,因为在子宫腺肌症患者中子宫内膜异位症的发生率高达26%[45]。
忽略了有症状的子宫腺肌症的患者合并子宫内膜异位症可能使得症状控制不良。应建议患者在子宫腺肌症手术中切除子宫内膜异位症病灶,以减少术后持续的药物治疗和手术干预[45,53]。
子宫腺肌症和不孕症
虽然子宫腺肌症和不良妊娠结局,比如不孕症和流产之间存在联系,目前仍缺乏明确的证据[54]。遗憾的是,目前没有研究评估经超声检查诊断的子宫腺肌症患者本身生育力的证据。提出的机制包括子宫腔失去正常形态、炎症继发的肌层收缩变化和植入受损,存在局部缺,或粘附分子的低表达[54]。
一些研究已经评估了子宫腺肌症患者行辅助生殖技术治疗后的结局。一项meta分析纳入11个评估经影像学提示子宫腺肌症患者行体外受精结局的观察性研究,该研究结果表明子宫腺肌症患者的胚胎植入率、每个移植周期的临床妊娠率、每个胚胎移植的临床妊娠率和活产率显著低于无子宫腺肌症的患者(OR=0.59)[55]。此外,子宫腺肌症患者的流产率较高(OR=2.2)[55]。子宫内膜异位症可能是一个混杂因素。有2项研究只纳入子宫内膜异位症的患者,而在其他研究中,子宫内膜异位症患者的数量有所不同。然而,即使在子宫内膜异位症患者比例较低的研究中,仍然提示子宫腺肌症降低临床妊娠率,增加流产率。在接受供卵的患者中,子宫腺肌症只影响流产率和活产率[3],无论是(局灶性子宫腺肌症)的手术治疗还是GnRH-a治疗都能提高妊娠率[55]。另一项近期的meta分析,纳入和2017年meta分析中的10项相同的研究,以及另一项大型回顾性队列研究,发现子宫腺肌症患者的临床妊娠率降低,流产率增加。但是,活产率不受子宫腺肌症的影响[7]。这些meta分析中的研究异质性比较高,这可能会引起偏倚[7,55]。
新鲜或冷冻胚胎移植前需要GnRH-a治疗2-4个疗程或LNG-IUS治疗,可以改善患者体外受精的生殖预后。
一项纳入350例患者的回顾性队列研究发现,在冷冻胚胎移植前接受LNG-IUS治疗3个月的子宫腺肌症患者的持续妊娠率显著升高(41.1%vs29.5%)[56]。同样的,相关的回顾性研究表明,GnRH-a预处理有利于提高活产率和降低流产率[57-59]。目前,没有发表的随机对照试验评估GnRH-a预处理对子宫腺肌症患者的疗效。尽管在一些研究中,子宫腺肌症与较高的流产率有关,其中只有1项回顾性队列研究对其他混杂因素进行了适当的控制。Stanekova等人的研究[60]指出影像学提示子宫腺肌症与较高的流产率相关(44.1%vs15.3%),与母亲年龄、体重指数和胚胎遗传状态无关。
评估子宫腺肌症对生育能力影响的研究的一个重要局限性是缺乏诊断标准化。两项回顾性研究发现,子宫腺肌症患者超声特征的数量是个重要因素;随着特征数量的增加,妊娠率逐渐降低[61,62]。然而,近期一项大型前瞻性队列研究没有发现子宫腺肌症特征的数量对活产率的有影响[63]。另一项回顾性研究使用子宫腺肌症详细MUSA超声诊断标准来评估供卵患者的生殖结果,研究结果发现超声特征的数量或类型不能预测生殖结局;然而,超声特征中局限性病灶的大小能显著降低了活产率[64]。
结论
子宫腺肌症是一种常见的疾病,可导致经期大出血、盆腔疼痛和不良的妊娠结果。它可以通过经阴道超声进行诊断。治疗方案包括内科治疗(如LNG-IUS、地诺孕素)、介入治疗(如UAE)和/或手术治疗(如EA、子宫腺肌瘤切除术和全子宫切除术)。
推荐总结
1.对于出现经期大出血、盆腔疼痛、不孕症、流产和不良妊娠结局的患者,经阴道超声应作为疑似子宫腺肌症一线诊断方式(强/高)。
2.症状提示有子宫腺肌症的患者,应由放射科医生经阴道超声评估以下情况:子宫腺肌症的典型特征,部位、局灶性或弥漫性病变、囊性或非囊性病变,子宫肌层受累,病变的程度,最大的病灶大小和受累区域的大小(强/高)。
3.如果对子宫腺肌症的超声评估不确定或怀疑伴有严重的盆腔病理性病变的患者,临床医生应考虑进行磁共振成像(有条件的/中)。
4.口服避孕药、左炔诺孕酮宫内缓释系统(LNG-IUS)和地诺孕素应作为治疗子宫腺肌症引起的疼痛和经期大出血的一线治疗方案(强/高)。
5.促性腺激素释放激素激动剂(GnRH-a)是治疗子宫腺肌症引起的疼痛和经期大出血的二线治疗药物;如果使用GnRH激动剂超过6个月,应该反向添加激素(强/低)。
6.子宫动脉栓塞是治疗与子宫腺肌症相关的大出血和疼痛的有效选择;它可以提供给已经完成生育并希望保留子宫的患者(强/中)。
7.微创热消融术,如高强度聚焦超声(HIFU)、射频消融(RFA)和经皮微波消融,未来可能用于治疗有症状的子宫腺肌症患者,但在研究背景之外使用前还需要更多的数据(有条件的/低)。
8.腺肌瘤切除术是治疗有症状的子宫腺肌症的有效治疗方案(强/中)。
9.腺肌瘤切除术是一个具有挑战性的外科手术,可能存在严重的手术并发症,应由经验丰富的外科医生进行(强/低)。
10.局灶性子宫腺肌症可以采用微创途径(腹腔镜、机器人)进行手术切除;然而,弥漫性子宫腺肌症最好采用经腹的手术方式(有条件的,低)。
11.考虑到术中出血的风险,贫血(血红蛋白<120g/L)应在腺肌瘤切除术前进行纠正(强/低)。
12.接受腺肌瘤切除术的患者,应该告知她们这些治疗方法对于对生育和妊娠存在不确定的影响。特别需要告知她们在怀孕期间子宫破裂的风险增加,以及必要时需要提前剖宫产(强/低)。
13.全子宫切除术是治疗有症状的子宫腺肌症的一种有效的治疗方案,适用于那些完成生育要求,并且在经过适当的风险和益处咨询和替代治疗的妇女(强/低)。
14.由于痛经接受接受手术治疗的子宫腺肌症患者,应建议同时切除存在的子宫内膜异位病灶,以更完全的缓解其症状(强/低)。
15.子宫腺肌症患者行保留生育力治疗对妊娠结局的影响尚不确定(有条件的/低)。
16.对于接受体外受精的子宫腺肌症患者,在移植新鲜或冷冻胚胎之前,可考虑将促性腺激素释放激素激动剂(GnRH-a)使用下调为2-4个月(弱/低)。

参考文献
1.Gordts S, Grimbizis G, Campo R. Symptoms and classification of uterine adenomyosis, including the place of hysteroscopy in diagnosis. Fertil Steril 2018;109:380e388.e1.
2.Naftalin J, Hoo W, Pateman K, et al. How common is adenomyosis? A prospective study of prevalence using transvaginal ultrasound in a gynaecology clinic. Hum Reprod 2012;27:3432e9.
3.Pinzauti S, Lazzeri L, Tosti C, et al. Transvaginal sonographic features of diffuse adenomyosis in 18e30-year-old nulligravid women without endometriosis: association with symptoms. Ultrasound Obstet Gynecol 2015;46:730e6.
4.Puente JM, Fabris A, Patel J, et al. Adenomyosis in infertile women: prevalence and the role of 3D ultrasound as a marker of severity of the disease. Reprod Biol Endocrinol 2016;14:60.
5.Naftalin J, Hoo W, Nunes N, et al. Association between ultrasound features of adenomyosis and severity of menstrual pain. Ultrasound Obstet Gynecol 2016;47:779e83.
6.Naftalin J, Hoo W, Pateman K, et al. Is adenomyosis associated with menorrhagia? Hum Reprod 2014;29:473e9.
7.Nirgianakis K, Kalaitzopoulos DR, Schwartz ASK, et al. Fertility, pregnancy and neonatal outcomes of patients with adenomyosis: a systematic review and meta-analysis. Reprod Biomed Online 2021;42:185e206.
8.Munro MG. Classification and reporting systems for adenomyosis. J Minim Invasive Gynecol 2020;27:296e308.
9.Van den Bosch T, de Bruijn AM, de Leeuw RA, et al. Sonographic classification and reporting system for diagnosing adenomyosis. Ultrasound Obstet Gynecol 2019;53:576e82.
10.Tellum T, Nygaard S, Skovholt EK, et al. Development of a clinical prediction model for diagnosing adenomyosis. Fertil Steril 2018;110:957e964.e3.
11.Bazot M, Daraï E. Role of transvaginal sonography and magnetic resonance imaging in the diagnosis of uterine adenomyosis. Fertil Steril 2018;109:389e97.
12.Maxim M, Dason ES, Chan C, et al. Current diagnosis and management of adenomyosis in Canada: a survey of Canadian gynaecologists. J Endometr Pelvic Pain Disord 2022;14:98e105.
13.Zannoni L, Ambrosio M, Raimondo D, et al. Question mark sign and transvaginal ultrasound uterine tenderness for the diagnosis of adenomyosis: a prospective validation. J Ultrasound Med 2020;39:1405e12.
14.Loring M, Chen TY, Isaacson KB. A systematic review of adenomyosis: it is time to reassess what we thought we knew about the disease. J Minim Invasive Gynecol 2021;28:644e55.
15.Olgan S, Dirican EK, Ozsipahi AC, et al. Uterine involvement by endometriosis: sonographic features from elusive findings to apparent adenomyosis. Eur J Obstet Gynecol Reprod Biol 2021;262:93e8.
16.Andres MP, Borrelli GM, Ribeiro J, et al. Transvaginal ultrasound for the diagnosis of adenomyosis: systematic review and meta-analysis. J Minim Invasive Gynecol 2018;25:257e64.
17.Marques ALS, Andres MP, Mattos LA, et al. Association of 2D and 3D transvaginal ultrasound findings with adenomyosis in symptomatic women of reproductive age: a prospective study. Clinics (Sao Paulo) 2021;76:e2981.
18.Champaneria R, Abedin P, Daniels J, et al. Ultrasound scan and magnetic resonance imaging for the diagnosis of adenomyosis: systematic review comparing test accuracy. Acta Obstet Gynecol Scand 2010;89:1374e84.
19.Rees CO, Nederend J, Mischi M, et al. Objective measures of adenomyosis on MRI and their diagnostic accuracy-a systematic review & meta-analysis. Acta Obstet Gynecol Scand 2021;100:1377e91.
20.Takeuchi M, Matsuzaki K. Adenomyosis: usual and unusual imaging manifestations, pitfalls, and problem-solving MR imaging techniques. RadioGraphics 2011;31:99e115.
21.Movilla P, Morris S, Isaacson K. A systematic review of tissue sampling techniques for the diagnosis of adenomyosis. J Minim Invasive Gynecol 2020;27:344e51.
22.Jeng CJ, Huang SH, Shen J, et al. Laparoscopy-guided myometrial biopsy in the definite diagnosis of diffuse adenomyosis. Hum Reprod 2007;22:2016e9.
23.Singh S, Best C, Dunn S, et al. No. 292-abnormal uterine bleeding in premenopausal women. J Obstet Gynaecol Can 2018;40:e391e415.
24.Ozdegirmenci O, Kayikcioglu F, Akgul MA, et al. Comparison of levonorgestrel intrauterine system versus hysterectomy on efficacy and quality of life in patients with adenomyosis. Fertil Steril 2011;95:497e502.
25.Shaaban OM, Ali MK, Sabra AMA, et al. Levonorgestrel-releasing intrauterine system versus a low-dose combined oral contraceptive for treatment of adenomyotic uteri: a randomized clinical trial. Contraception 2015;92:301e7.
26.Abbas AM, Samy A, Atwa K, et al. The role of levonorgestrel intra-uterine system in the management of adenomyosis: a systematic review and meta-analysis of prospective studies. Acta Obstet Gynecol Scand 2020;99:571e81.
27.Song SY, Lee SY, Kim HY, et al. Long-term efficacy and feasibility of levonorgestrel-releasing intrauterine device use in patients with adenomyosis. Med (Baltim) 2020;99:e20421.
28.Li L, Leng J, Jia S, et al. Treatment of symptomatic adenomyosis with the levonorgestrel-releasing intrauterine system. Int J Gynaecol Obstet 2019;146:357e63.
29.Chen S, Wang J, Sun W, et al. Efficacy of the levonorgestrel-releasing intrauterine device is associated with different subtypes of adenomyosis: a retrospective study. Ann Transl Med 2020;8:1356.
30.Osuga Y, Watanabe M, Hagino A. A randomized, double-blind, multicenter, placebo-controlled study of dienogest in the treatment of painful symptoms in patients with adenomyosis in Japan. Jpn Pharmacol Ther 2017;45:907e20.
31.Hassanin AI, Youssef AAAM, Yousef AM, et al. Comparison of dienogest versus combined oral contraceptive pills in the treatment of women with adenomyosis: a randomized clinical trial. Int J Gynaecol Obstet 2021;154:263e9.
32.Ono N, Asano R, Nagai K, et al. Evaluating the safety of dienogest in women with adenomyosis: a retrospective analysis. J Obstet Gynaecol Res 2021;47:1433e40.
33.Neriishi K, Hirata T, Fukuda S, et al. Long-term dienogest administration in patients with symptomatic adenomyosis. J Obstet Gynaecol Res 2018;44:1439e44.
34.Muneyyirci-Delale O, Chandrareddy A, Mankame S, et al. Norethindrone acetate in the medical management of adenomyosis. Pharmaceuticals (Basel) 2012;5:1120e7.
35.Vannuccini S, Luisi S, Tosti C, et al. Role of medical therapy in the management of uterine adenomyosis. Fertil Steril 2018;109:398e405.
36.Matsushima T, Akira S, Fukami T, et al. Efficacy of hormonal therapies for decreasing uterine volume in patients with adenomyosis. Gynecol Minim Invasive Ther 2018;7:119e23.
37.Andreeva E, Absatarova Y. Triptorelin for the treatment of adenomyosis: a multicenter observational study of 465 women in Russia. Int J Gynaecol Obstet 2020;151:347e54.
38.Matsushima T, Akira S, Yoneyama K, et al. Recurrence of uterine adenomyosis after administration of gonadotropin-releasing hormone agonist and the efficacy of dienogest. Gynecol Endocrinol 2020;36:521e4.
39.Vannuccini S, Petraglia F. Recent advances in understanding and managing adenomyosis. F1000Res 2019;8:Faculty Rev-283.
40.Akira S, Mine K, Kuwabara Y, et al. Efficacy of long-term, low-dose gonadotropin-releasing hormone agonist therapy (draw-back therapy) for adenomyosis. Med Sci Monit 2009;15:CR1e4.
41.Donnez O, Donnez J. Gonadotropin-releasing hormone antagonist (linzagolix): a new therapy for uterine adenomyosis. Fertil Steril 2020;114:640e5.
42.Tosti C, Vannuccini S, Troìa L, et al. Long-term vaginal danazol treatment in fertile age women with adenomyosis. J Endometriosis Pelvic Pain Disord 2017;9:39e43.
43.Capmas P, Brun JL, Legendre G, et al. Ulipristal acetate use in adenomyosis: a randomized controlled trial. J Gynecol Obstet Hum Reprod 2021;50:101978.
44.Badawy AM, Elnashar AM, Mosbah AA. Aromatase inhibitors or gonadotropin-releasing hormone agonists for the management of uterine adenomyosis: a randomized controlled trial. Acta Obstet Gynecol Scand 2012;91:489e95.
45.Chen J, Porter AE, Kho KA. Current and future surgical and interventional management options for adenomyosis. Semin Reprod Med 2020;38:157e67.
46.de Bruijn AM, Smink M, Lohle PNM, et al. Uterine artery embolization for the treatment of adenomyosis: a systematic review and meta-analysis. J Vasc Interv Radiol 2017;28:1629e1642.e1.
47.de Bruijn AM, Lohle PN, Huirne JA, et al. Uterine artery embolization versus hysterectomy in the treatment of symptomatic adenomyosis: protocol for the randomized QUESTA trial. JMIR Res Protoc 2018;7:e47.
48.Zhou J, He L, Liu P, et al. Outcomes in adenomyosis treated with uterine artery embolization are associated with lesion vascularity: a long-term follow-up study of 252 cases. PLoS One 2016;11:e0165610.
49.Smeets AJ, Nijenhuis RJ, Boekkooi PF, et al. Long-term follow-up of uterine artery embolization for symptomatic adenomyosis. Cardiovasc Intervent Radiol 2012;35:815e9.
50.Philip CA, Le Mitouard M, Maillet L, et al. Evaluation of NovaSure® global endometrial ablation in symptomatic adenomyosis: a longitudinal study with a 36 month follow-up. Eur J Obstet Gynecol Reprod Biol 2018;227:46e51.
51.Lou J, Huang X, Zhang L, et al. [The second generation endometrial ablation (NovaSure) improves efficacy of levonorgestrel-releasing intrauterine system in management of adenomyosis]. Zhejiang Da Xue Xue Bao Yi Xue Ban 2019;48:136e41.
52.Osada H. Uterine adenomyosis and adenomyoma: the surgical approach. Fertil Steril 2018;109:406e17.
53.Thurston J, Murji A, Scattolon S, et al. No. 377-hysterectomy for benign gynaecologic indications. J Obstet Gynaecol Can 2019;41:543e57.
54.Squillace ALA, Simonian DS, Allegro MC, et al. Adenomyosis and in vitro fertilization impacts - A literature review. JBRA Assist Reprod 2021;25:303e9.
55.Younes G, Tulandi T. Effects of adenomyosis on in vitro fertilization treatment outcomes: a meta-analysis. Fertil Steril 2017;108:483e490.e3.
56.Liang Z, Yin M, Ma M, et al. Effect of pretreatment with a levonorgestrelreleasing intrauterine system on IVF and vitrified-warmed embryo transfer outcomes in women with adenomyosis. Reprod Biomed Online 2019;39:111e8.
57.Park CW, Choi MH, Yang KM, et al. Pregnancy rate in women with adenomyosis undergoing fresh or frozen embryo transfer cycles following gonadotropin-releasing hormone agonist treatment. Clin Exp Reprod Med 2016;43:169e73.
58.Lan J, Wu Y, Wu Z, et al. Ultra-long GnRH agonist protocol during IVF/ICSI improves pregnancy outcomes in women with adenomyosis: a retrospective cohort study. Front Endocrinol 2021;12:609771.
59.Niu Z, Chen Q, Sun Y, et al. Long-term pituitary downregulation before frozen embryo transfer could improve pregnancy outcomes in women with adenomyosis. Gynecol Endocrinol 2013;29:1026e30.
60.Stanekova V, Woodman RJ, Tremellen K. The rate of euploid miscarriage is increased in the setting of adenomyosis. Hum Reprod Open 2018;2018:hoy011.
61.Mavrelos D, Holland TK, O’Donovan O, et al. The impact of adenomyosis on the outcome of IVF-embryo transfer. Reprod Biomed Online 2017;35:549e54.
62.Sharma S, Bathwal S, Agarwal N, et al. Does presence of adenomyosis affect reproductive outcome in IVF cycles? A retrospective analysis of 973 patients. Reprod Biomed Online 2019;38:13e21.
63.Higgins C, Fernandes H, Da Silva Costa F, et al. The impact of adenomyosis on IVF outcomes: a prospective cohort study. Hum Reprod Open 2021;2021:hoab015.
64.Dason ES, Maxim M, Hartman A, et al. Pregnancy outcomes with donor oocyte embryos in patients diagnosed with adenomyosis using the Morphological Uterus Sonographic Assessment (MUSA) criteria. Fertil Steril 2023;119:484e9.
上下滑动查看
北京协和医学院2021级妇产科学博士研究生
研究方向:妇科肿瘤的临床和基础研究,尤其是妇科肿瘤的免疫治疗
在国内外杂志公开发表学术论文25篇,SCI收录22篇,其中第一作者或者共第一作者12篇;参与译著2本。

福建医科大学附属福建省妇幼保健院副院长、福建省妇儿重大疾病重点实验室常务副主任,主任医师、教授、博士生导师。德国妇科癌症协会(NOGGO)、国际妇科癌症协会(IGCS)会员、中国抗癌协会理事、福建省抗癌协会妇科肿瘤专业委员会副主任委员、国家远程与互联网医学中心妇科肿瘤专家委员会常委、中国优生科学协会CSCCP常委、FJSCCP主任委员、中国老年医学妇科学分会常委、中国医药教育协会妇产科协会宫颈病变专委会常委、中国医师协会妇产科分会阴道镜和宫颈病变专业委员、微无创专委会妇科肿瘤专业委员、中华预防医学会生殖健康专业委员会委员、妇幼保健专业委员会常见病学组委员。担任BMC medicine,oncogene等Q1期刊审稿专家,《中国妇产科临床杂志》编委、《国际妇产科学》杂志编委、《医学参考—妇产科频道》编委。入选福建省“特支双百”百千万领军人才,福建省卫健委突出贡献中青年专家。长期从事妇产科临床工作,对妇科疑难杂症的诊断和治疗有丰富的临床经验,致力于妇科肿瘤微创化、个体化精准治疗,对生殖道感染和内分泌有一定的研究。擅长运用手术、放化疗综合手段治疗各种妇科恶性肿瘤,如宫颈癌、子宫内膜癌、卵巢癌等。熟练掌握妇科肿瘤微无创技术,尤其擅长单孔腹腔镜和多孔腹腔镜手术。主持及参与国家级课题9项,省厅级课题20余项,申请专利7项,获科技奖励8项,在国内外杂志上公开发表学术论文180余篇,其中SCI收录论文81篇,累计影响因子超300分,出版学术著作或译著10本,参与编撰的专家共识指南10部。

现任中国医学科学院中国协和医科大学北京协和医院妇产科肿瘤妇科中心主任兼妇产科学系副主任、教授、博士研究生导师。担任国际滋养细胞肿瘤学会执行委员及第18届执行主席,中华医学会妇科肿瘤分会副主任委员,中华医学会妇产科学分会委员,中国抗癌协会妇科肿瘤专业委员会常委,北京医学会妇科肿瘤分会主任委员,北京医学会妇产科分会副主任委员,北京医师协会妇产科分会副会长,卫生部高级技术职称评定专家委员会委员,《中国妇产科临床杂志》副主编,《中国医学论坛报》妇科肿瘤特约主任编委,《国外医学妇产科分册》、《中国实用妇科与产科杂志》常务编委,《中华妇产科杂志》、《现代妇产科进展》、《中国医刊》等杂志编委。主要致力于妇科肿瘤与妇产科遗传的临床及实验研究,对妇产科疑难杂症的诊断与治疗具有丰富的临床经验,尤其对滋养细胞肿瘤的诊断与治疗有独特的见解并取得重要成绩。擅长各种类型的妇科手术,包括腹腔镜下子宫肌瘤剔除术、全子宫切除术以及妇科恶性肿瘤的清扫手术。并相继获得多项国家自然科学基金,国家十五公关项目、国家十一五支撑计划、国家教委,卫生部及医科院科研基金资助。关于“阴道超声在妇产科的应用”及“耐药与危重绒癌病例治疗的研究”分别于1998年及2000年获得北京市科学技术进步二等奖。关于“产前诊断新技术的系列研究与临床应用”于2005年获得中华医学科技二等奖。“协和医师答疑丛书”获得2006年国家科技进步二等奖。“滋养细胞耐药的基础与临床研究”获得2007年中华医学科技三等奖。“滋养细胞肿瘤综合诊治技术的研究与推广应用”获得2017年北京市科技进步二等奖、2017年国家教委科技进步二等奖等。1999年被评为卫生部优秀青年科技人才。曾被卫生部共青团中央授予1999年-2000年度“全国卫生系统青年岗位能手”。于2004年获得由人事部等七部委授予的“首批新世纪百千万人才工程国家级人选”称号。享受政府特殊津贴。近30年来,在国内外学术刊物共发表论文500余篇,其中SCI论文100余篇。主编及参与编写医学著作数十部。
1.文章仅代表作者观点,原创内容版权归妇产科网平台所有,转载内容版权归原作者所有。
2.如文章内容有误或涉及作品版权问题烦请告知,我们及时予以更正/删除。
3.凡向妇产科网投稿作者,投稿人务必保证稿件的原创性,如果稿件因抄袭、侵权等导致纠纷或法律后果,由投稿人本人负责,与妇产科网无关。
4.本平台发布的内容仅供医疗卫生专业人士用于学术交流和科学研究,并不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。
特此声明!
转载:妇产科网



