转载:博习医鉴 | 第六期 妊娠合并肝脏占位性病变多家医院病理结果不一,如何抉择?
作者:李晓宇1,韩冰2,许春芳3,赵华4,王希明5,董凤林6,刘文婷7,陈洁8
作者单位:苏州大学附属第一医院,江苏省苏州市 215000
通信作者:韩冰,电子邮箱:hanbing@suda.edu.cn
肝脏占位性病变的鉴别诊断多依靠影像学检查,但相关检查在妊娠期的应用受限给妊娠女性肝脏占位的诊断与治疗带来了挑战。 2023年欧洲肝病学会发布的关于妊娠期肝病管理指南中提及妊娠期间发现的肝脏占位多为良性,如肝细胞腺瘤(Hepatocellular adenoma,HCA)、血管瘤(Hepatic hemangioma)和局灶性结节性增生(Focal nodular hyperplasia,FNH),其中FNH是仅次于血管瘤的第二常见良性肝肿瘤[1]。 本期内容报道此例妊娠合并肝脏占位性病变患者(术后病理证实为FNH),旨在为类似患者的诊疗提供指导思路。 【现病史】 患者女性,33岁,已婚已育。LMP:2022-11-05,EDC:2023-08-12(孕周已核对)。本次系自然受孕,早孕反应轻,孕期无病毒感染,无放射性毒物接触史。停经18周出现胎动,停经16周于我院行正规产检,唐氏筛查示21三体综合征风险值为1:418,遗传门诊咨询后行无创产前DNA检测为低风险。甲功正常,TORCH无异常,建卡时发现HPV39阳性,TCT(Thinprep
cytologic test,液基细胞学检查)阴性。OGTT(Oral glucose tolerance
test,口服葡萄糖耐量试验)阴性,排畸B超未见异常。 患者孕16周发现生化相关指标异常:总胆汁酸(Total
bile acids,TBA)43.6μmol/L,谷丙转氨酶(Alanine
aminotransferase,ALT)35.8μmol/L,谷草转氨酶(Aspartate
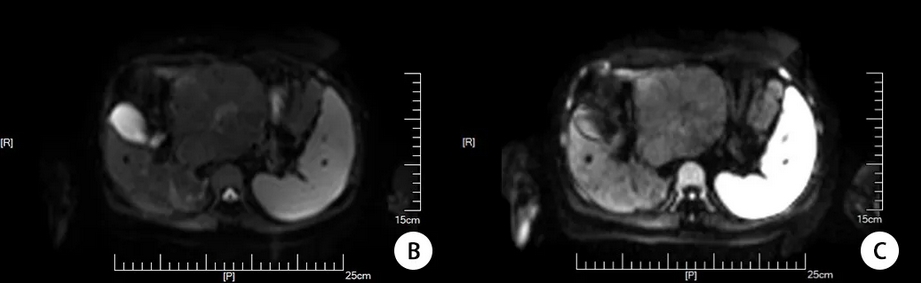
aminotransferase,AST)37.8μmol/L,门诊予熊去氧胆酸胶囊250mg tid口服,定期复查相关指标。 孕20周开始出现皮肤瘙痒,2023-03-31(孕20+6周)因TBA及肝酶异常病情控制不佳住院。住院期间予思美泰静滴、熊去氧胆酸口服治疗,监测相关指标,因肝胆胰脾B超提示肝左叶占位,完善多学科会诊,遵会诊意见完善肝脏+肝血管超声、MRI、全外显子基因检测和切片会诊等,规律复查肝酶及TBA,孕34+2周入院待产。现患者偶有皮肤瘙痒,无腹痛腹胀及阴道流血流液等不适,无纳差、乏力,两便正常。 【既往史】 既往体健,否认高血压、糖尿病、肾病病史,否认肝炎、结核等传染病史。无外伤史。否认食物药物过敏史。 手术史:2013年剖宫产术,2010年于老家市立医院因肝脏占位行开腹肝V、VI、VII段切除术,术中见肿瘤位于右肝,大小约12cm*10cm,有包膜,完整切除肿物,病理结果为病理结果示镜下见肝细胞增生,正常结构消失,部分区域肝细胞轻度异型,结合免疫标记结果CD34+血管丰富,不排除高分化肝细胞性肝癌。 免疫标记(2010-2803):CD34+、Gpc-3-、AFP-、CD10-、Ki-67+约3%。(建议外会诊进一步确诊)后自诉复旦大学附属中山医院病理科会诊结果为良性,遂未进一步随访。 【婚育史】 1-0-1-1(2013年外院剖宫产一男婴,重3400g;2018年因个人因素药流)。适龄结婚,配偶及1子体健。 【月经史】 初潮12岁,5/30日,量中,无痛经。 【家族史】 否认家族遗传病史及类似疾病史。 【入院后的检查检验】 查体: T:36.8℃,BP:106/69mmHg,P:80pm,R:20次/分,身高168cm,体重74kg,BMI:26.22kg/m2。神清,精神可,皮肤粘膜无黄染,全身浅表淋巴结无肿大,全身无浮肿,瞳孔等大等圆,对光反应好,巩膜无黄染,甲状腺无肿大,心肺听诊无异常,腹软,膨隆,肝脾肋下未及。脊柱四肢无畸形,生理反射存在,病理反射未引出。外阴无浮肿,无静脉曲张,无疤痕。产科检查:宫高:30cm,腹围:100cm,估计胎儿大小:2800g,胎方位:LOA,胎心:152次/分。 辅助检查: 2023-04-01,肿瘤全套(女性):甲胎蛋白57.18μg/L,肿瘤特异生长因子75.40U/mL;血凝常规、输血常规、自免肝组合均未见明显异常。 2023-04-01,肾输B超:右肾异常回声,考虑错构瘤可能。左肾及双输未见明显异常。 2023-04-01,肝胆胰脾B超:肝内多发实性占位性病变,其一大小约139mm*107mm,位于左叶,肝K?,建议超声造影,胆囊息肉,建议随访,脾脏肿大。 2023-04-06,肝脏+肝血管超声:肝左叶实性占位性病变,FNH?门静脉右支及肝右静脉回声异常,考虑门体侧枝循环开放,肝动脉流速增高。 2023-04-24,MRI:肝左叶见类圆形等T1等T2信号,内可见条片状稍长T2信号,大小约125mm*113mm,DWI呈等稍高信号,信号不均,其内见疤痕样改变,门脉及肝静脉呈受压改变,肝右叶见迂曲扩张静脉血管影。提示肝左叶占位,门脉及肝脉受压改变,FNH可能;建议普美显增强检查;肝右叶异常增粗静脉血管影。脾大。 2023-04-29,全外显子基因检测报告示:未检出与受检者临床表型相关的致病/疑似致病变异/遗传模式相符的临床意义未明变异。在Meckel综合征7型/肾-肝-胰腺发育不良1型/肾单位肾痨3型相关的NPHP3基因上检出与受检者表型部分相关的1个疑似致病变异。在肾单位肾痨16型相关的ANKS6基因上检出与受检者表型部分相关的2个意义未明变异。在严重的先天性肝病相关的FOCAD基因上检出与受检者表型部分相关的1个意义未明变异。在家族进行性肝内胆汁淤积6型相关的SLC51A基因上检出与受检者表型部分相关的1个意义未明变异。 图1:孕期MRI平扫 A:T1; B:T2; C:DWI 【入院诊断】 1.妊娠期肝内胆汁淤积症; 2.肝占位性病变:FNH? 肝脏恶性肿瘤?; 3.妊娠合并子宫瘢痕; 4.妊娠合并人类乳头状瘤病毒感染; 5.G3P1孕34+2周LOA待产。 鉴别诊断: 2.肝血管瘤:良性,常见病史为先天发育异常,症状有上腹不适、腹胀、嗳气,腹部肿块、光滑、柔软,CT可见肝内占位,增强CT“早出晚归”。 3.肝腺瘤:良性,发生在中青年女性,患者长期服用口服避孕药,肝腺瘤可能发生破裂、出血、转变成恶性病变。 4.再生结节(肝硬化结节):发生于肝硬化的患者,肝硬化患者在肝脏进行性纤维化的过程中会出现再生结节。 5.原发性肝癌:常见病史为乙肝、肝硬化,症状有,肝区疼痛、乏力、消瘦,肝大、右上腹包块,凹凸不平,CT可见肝内占位,增强CT“快进快出”。 6.转移性肝癌:单个或多个肿块/结节,有肝外恶性肿瘤(如结肠癌,胰腺癌),AFP一般不高。 7.肝包虫病:常见病史为疫区居住,症状有上腹不适、隐痛,腹部囊性肿块、肝大、无触痛,CT可见肝内占位,环行钙化。 8.肝脓肿:常见的肝脓肿有细菌性和阿米巴性两种。 患者育龄期女性,已婚已育,隐性起病,因“发现总胆汁酸升高”就诊。既往肝脏肿瘤病史,术后切片病理恶性不能排除,孕期发现肝内多发实性占位性病变,左叶其一大小约139mm*107mm。肿瘤指标未见明显异常。 于孕34+3周在连续硬膜外麻醉下行子宫下段剖宫产终止妊娠。剖宫产后65天在全麻下行部分肝切除术。 因既往肝脏手术史,恶性不能除外。故借病理蜡块我院病理科会诊提示高分化腺癌。再次送中山医院病理科会诊提示:(右肝)肝细胞增生性病变,伴大量血湖及畸形血管,符合局灶结节性增生改变。结合影像及皮肤瘀点,不排除遗传性毛细血管扩张症致肝脏病,遂完善腹部MRI及全外显子基因检测等。 孕32+3周行多学科会诊,普外科、消化科、影像科、超声科、病理科、产科联合会诊意见: 根据患者目前影像学指标,从核磁结果来看,因孕期普美显造影受限,肿块弥散成像未见明显弥散受限,不支持恶性肿瘤。核磁可见血管畸形,门脉和肝中静脉吻合,门脉进入肝内后增粗明显,提示可能门脉和体循环肝静脉吻合支,FNH也好发有血管畸形不能,故排除先天性或手术后改变。从超声结果来看肿块较大,肝脏质地尚可,门脉主干不宽。就肿块形态和整体表现,中央轮辐状血流明显,整体考虑FNH可能性。但是确实需要和高分化腺癌进行鉴别。现肿块较大,相对于超声而言,核磁测量相对比较准确。建议MRI动态监测是否有明显变化。 从病理科角度来看,FNH和高分化腺癌很难区别,中山医院会诊结果为符合局灶结节性增生改变,就免疫组化结果,我院的病理诊断和患者手术医院的结论相符合。仍不能排除高分化腺癌的可能。是否可以和十年前的结果用一元论解释,建议分娩后再次针对该次肿瘤的病理检查。 既往我院有类似病例,结合既往无肝炎病史,无肝硬化基础,无酗酒史,除十年前手术史以外,无其他既往肝病基础,肝功能正常,且病程相对比较长,考虑本次肝脏占位首先考虑FNH可能性大。就该病而言,现无门脉高压表现,不影响终止妊娠的时机。建议产后专科完善相关检查后评估后续肝脏手术时机和方式。 针对目前胆汁淤积,现已经对症进行处理(优思弗,思美泰足量治疗),可考虑加用激素治疗,甲强龙40-60mg/d,注意对症支持处理。如果有效,3天左右可以监测到胆汁酸明显下降。如果无效,可以按产科ICP处理。产后完善普美显增强造影,根据结果评估后续诊疗方案。 针对TBA增高,先后采用口服熊去氧胆酸胶囊(优思弗)250mg tid,静滴思美泰0.5g qd保肝,多学科联合会诊(Multi-disciplinary team,MDT)后加用甲泼尼龙40mg口服治疗,07-02(孕34+1周)复查TBA49.5μmol/L。 考虑患者重度ICP,合并肝脏不明性质的占位性病变,与患者及家属充分沟通后于孕34+3周在连续硬膜外麻醉下行子宫下段剖宫产终止妊娠。术中取耻骨联合上三横指原疤痕部位横切口,长约12厘米,进腹探查见:子宫轻度右旋,下段形成一般,膀胱与子宫前壁粘连,横形切开子宫下段,见羊水清,量约1000ml,手托头顺利娩出一女婴,2400g,Apgar评分10-10分,清理呼吸道后交台下处理,因“早产儿”后续转儿童医院进一步诊治。胎盘胎膜自娩完整,顶端加固后常规缝合子宫。术中按摩子宫及缩宫素宫体注射后子宫收缩可,出血共约300ml,探查双侧附件未见明显异常。检查子宫下段切口无活动性出血,脂肪,肌肉及皮肤多处渗血,严密缝合止血后未见活动性出血。清点纱布器械无误,逐层关腹,安返病房。术后阴道检查,宫口未开,阴道内积血约20ml。保留导尿清。 术后诊断: 1.妊娠期肝内胆汁淤积症; 2.肝占位性病变:FNH? 肝脏恶性肿瘤?; 3.妊娠合并子宫瘢痕; 4.妊娠合并人类乳头状瘤病毒感染; 5.早产; 6.G3P2孕34+3周LOA剖宫产。 剖宫产术后第四天,患者一般情况好,阴道出血不多。查体双乳不胀,腹部切口干燥,无红肿硬结,腹软,无压痛反跳痛,宫底脐下两指余。予出院。 出院后患者随访TBA及肝酶恢复正常。2023-08-31(剖宫产后58天)入住我院普外科。 完善术前常规检查及肿瘤全套:甲胎蛋白<2μg/L,癌胚抗原1.95ng/mL,糖类抗原CA199
2.44U/mL,糖类抗原CA125 10.70U/mL,糖类抗原CA153 6.80U/mL,CA50 6.75U/ml,CA72-4
0.51U/ml,异常凝血酶原测定20.33mAU/mL,糖链抗原242 3.23IU/ml。余未见明显异常。 2023-09-04胸腹盆增强CT示:肝左叶占位,考虑FNH可能,建议结合MRI;肝右叶异常增粗静脉血管影;肝内钙化灶,肝尾状叶囊肿;脾大;少量盆腔积液;双肺多发小结节,部分GGO,建议定期随访复查;双侧腋窝稍大淋巴结,建议结合临床。 2023-09-05上腹部MRI平扫+增强+MRCP示:肝左叶占位,考虑纤维板层样肝K,伴肝内转移可能;门静脉左支癌栓形成;肝电静脉、门静脉增宽迁曲,考虑血管畸形伴局部灌注异常;肝硬化;脾大。 2023-09-07患者在全麻下行部分肝切除术,取上腹部反L切口,长约30厘米,逐层进腹,结扎离断肝圆韧带,腹腔局部网膜粘连,分离粘连后探查:腹腔无腹水,腹盆腔未见转移结节,肝脏质地正常,肝内触及多发质韧结节,界清,较大者位于左尾状叶,直径约12cm。胆囊大小如常,胆总管不增粗,肝门部未见肿大淋巴结。胃、十二指肠、胰腺、脾脏未及异常。 结合术前检查,术中诊断:肝多发FNH,拟行尾状叶切除+左肝结节活检。离断镰状韧带,左管状韧带,左三角韧带,充分游离左肝。打开肝胃韧带,结扎离断变异左肝动脉,充分显露肿块。将肿瘤掀起,显露后方下腔静脉,结扎离断数支发至腔旁尾叶的肝段静脉后,于肿瘤右侧缘紧贴肿瘤用超声刀离断肝实质,离断过程中游离数支肿瘤滋养动脉,分别结扎后离断。在离断肝实质过程中,逐步显露下腔静脉前壁至右侧尾状叶,分别显露结扎至尾状叶的肝短静脉,自下而上紧贴肿瘤至全尾状叶完整切除。另取左外叶一结节,超声刀将其完整取下,移除尾状叶及左外叶结节手术标本。蒸馏水冲洗手术野,检查术区无活动性出血、胆漏,于文氏孔及肝断面各置硅胶管一根。清点器械敷料无误,逐层关腹术毕。 手术顺利,麻醉满意,术中阻断肝门3次,每次约15min,出血约1000毫升,输血900毫升,术中取材:尾状叶肿瘤:肝脏组织一块,16cm*12cm*9cm,距肝烧灼缘3.5cm见一2*1cm的灰白纠集区;左外叶肝结节:肝脏组织一块,7cm*5cm*1cm,局部已剖开,紧邻烧灼缘见第一处结节,2cm*1.5cm*1.3cm,切面灰黄,距第一处结节2.5cm距烧灼缘1cm见第二处结节,1.5cm*1cm*0.8cm。标本家属过目后送检,患者安返病房。 一周后术后常规病理回报:(肝尾状叶,左外叶肝)符合局灶结节性增生。 图2:术后病理切片(低倍10×HE染色) 2023-09-11(术后4天)复查胸腹盆CT平扫示:肝左叶术后;肝内钙化灶;脾大;少量盆腔积液;双肺多发小结节,部分GGO,双侧腋窝稍大淋巴结,右侧胸腔积液。 患者术后恢复良好,无明显不适,2023-10-30复查肝胆胰脾B超示:肝部分切除术后,余肝脏未见明显异常,建议必要时结合增强影像学检查。门静脉流速稍高,门静脉右支及肝右静脉内径增宽,请结合临床。胆囊息肉,建议随访。脾脏轻度肿大。胰腺未见明显异常。肝内外胆管未见明显扩张。复查双侧腋窝淋巴结B超:未见明显异常肿大淋巴结。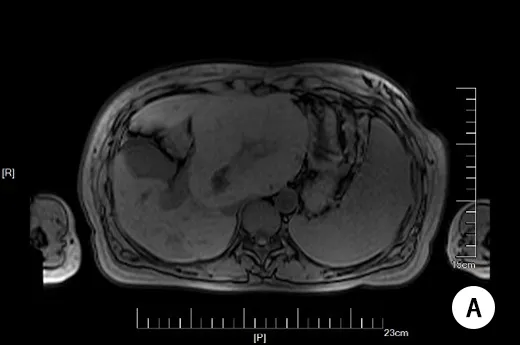
1.肝局灶结节增生:良性,通常表现为单个的肝脏结节,症状通常是非特异性的,增强CT“快进慢出”,另一个特征表现为中央疤痕。
妊娠合并肝脏占位性病变的处理主要取决于占位的性质。对肝脏病变进行诊断评估时,首先要确认患者有无肝恶性肿瘤的危险因素(如肝硬化、慢性乙肝病毒感染)或肝转移瘤的危险因素(如肝外恶性肿瘤病史)。对于没有恶性肝脏病变危险因素的患者,初始诊断评估主要基于病变的影像学表现。需要关注的病变特征包括:病变大小、外观(如边缘)、强化特征和生长模式。对于不明病变,通常首先用对比增强多期横断面成像检查来诊断。通常采用MRI,但如果患者有MRI禁忌证或无法使用MRI,则可采用CT扫描。如果经以上影像学检查后仍然病因不明,后续可以选择影像学引导下活检、手术切除或影像学监测[2]。 该例患者因妊娠状态,行增强影像学检查受限,由于该例患者2010年曾有过肝脏肿瘤病史,当地医院病理科全科讨论结果及我院病理科会诊均认为恶性肿瘤不排除,但复旦大学附属中山医院病理科考虑FNH,多家医院病理结果不一致,故此次再发肝占位,不能排除恶性肿瘤可能。然而参照肝恶性肿瘤的生物学特性及较差预后,该患者术后无症状生存十余年,又不符合肝恶性肿瘤的特征,此为本例患者诊断的矛盾之处。由于前次肿瘤的性质对本次诊疗具有重大指导意义,因此反复会诊讨论是十分必要的。 肝占位性病变常需要做增强MRI/CT,才能进一步明确诊断,故在此需讨论CT增强对比剂碘克沙醇/碘帕醇和肝脏MRI增强对比剂普美显(钆塞酸二钠)的妊娠安全性。根据美国食品和药物管理局分级,口服和静脉注射碘对比剂均被列为B类药物(尽管碘具有通过胎盘进入胎儿循环的能力,但在孕妇中使用碘并无致突变或致畸作用的报道);由于仅在动物模型中观察到不良反应和畸形,钆类的造影剂被归类为C类药物[3]。M.De Santis等报告了26名妊娠早期使用钆类造影剂的孕妇的结局,表明其对妊娠和新生儿结局无不良影响[4]。在加拿大的一项回顾性研究中,孕妇使用钆与死产、新生儿死亡、风湿病、炎症性疾病风险增加相关[5]。总而言之,妊娠期非必要尽量不应用增强检查,需充分权衡利弊,只有利明显大于弊时方可考虑应用。该患者产前行MRI平扫,虽不能明确肝占位的良恶性,但由高年资影像科医师读片以及充分的MDT讨论后,认为肝良性肿瘤-FNH可能性更大,权衡普美显增强的利弊及与患者和家属沟通后,该患者未行增强检查。 另外,患者拟行肝占位切除术前完善了增强CT及增强MRI,但两者结论仍不一致,CT考虑FNH可能,MRI考虑纤维板层样肝K,伴肝内转移可能,门静脉左支癌栓形成。因此,针对临床有疑问的病例,需要谨慎判读影像学结果,由有经验的影像科医师讨论,组织MDT,共同商讨患者的诊疗方案。
FNH于1958年由Edmondson首次描述[6],是仅次于血管瘤的第二大常见肝脏良性病变,发病率约0.03%-3%,约占所有原发性肝脏肿瘤的8%[7]。FNH是一种良性肝脏病变,由增生的肝细胞组成,病灶中央有星状瘢痕,此为影像学典型表现。FNH通常为孤立病变,好发于女性,该疾病的确切发病机制尚未完全确定,目前认为是由门静脉损伤引起的,导致动脉-静脉分流的形成和扩大[8]。该分流又会引起局部动脉的过度灌注,导致氧化应激,从而触发肝星状细胞的反应,继之产生典型中央瘢痕[9]。女性性激素被怀疑在FNH的发展中有一定的作用,因为女性不仅患病率更高,而且与男性相比,女性倾向于发展更大和更早的病变[10]。FNH可能没有症状而经影像学检查偶然发现,也可能有非特异性症状。
经MDT后,患者初步诊断为FNH可能性大,根据欧洲肝脏研究协会的指南推荐,在无症状和并发症罕见的情况下,FNH首选保守治疗。如有特殊情况如带蒂、扩大、外生等需治疗,手术切除为首选治疗。对于不适合切除的患者,应行非手术治疗。如果诊断明确且个体无症状,则不需要影像学随访,非孕期没有停用口服避孕药的指征,也没有必要在妊娠期间进行随访。如果影像学未能明确诊断FNH,或者患者有症状(与疼痛或压迫有关),则应将患者转诊至良性肝脏多学科会诊[2]。
由于FNH本身发病率不高,妊娠合并FNH相关报道不多,国内学者穆琳等报道了一例妊娠合并多发FNH患者,妊娠期定期复查未见肿瘤有明显变化,未影响终止妊娠时机及方式,未影响妊娠不良结局的发生[11];据国外报道,Weimann等对82例FNH患者进行了随访,报道其中10例患者共妊娠13次,肿瘤大小无变化[12]。Mathieu等随访了216例FNH患者,报道其中12例患者已妊娠,妊娠期间肿瘤大小无变化[13]。D'halluin等对44例FNH患者进行了回顾性研究。6例患者已妊娠,其中3例妊娠期间肿瘤大小无变化,2例缩小,仅1例增大40%[14]。
妊娠合并肝脏占位性病变的诊断依赖于影像学检查,需由有经验的多学科医师共同合作诊疗。由于FNH是一种好发于育龄期女性的肝脏良性肿瘤,因此未来有必要对FNH患者在妊娠期的进展进行关注和研究。
[1]European
Association for the Study of the Liver. EASL clinical practice
guidelines on the management of liver diseases in pregnancy[J]. J
Hepatol, 2023, 79(3): 768-828.
[2]European Association for the Study
of the Liver (EASL). EASL Clinical Practice Guidelines on the management
of benign liver tumours. J Hepatol. 2016;65(2):386-398.
[3]Mathur
S, Pillenahalli Maheshwarappa R, Fouladirad S, et al. Emergency Imaging
in Pregnancy and Lactation [Formula: see text]. Can Assoc Radiol J.
2020;71(3):396-402.
[4]De Santis M, Straface G, Cavaliere AF, et al.
Gadolinium periconceptional exposure: pregnancy and neonatal
outcome. Acta Obstet Gynecol Scand. 2007;86(1):99-101.
[5]Ray JG,
Vermeulen MJ, Bharatha A, et al. Association between MRI exposure during
pregnancy and fetal and childhood outcomes. JAMA. 2016;316(9):952-961.
[6]Wilson
T. S., Mcgregor J. W. Focal nodular hyperplasia of the liver: the
solitary cirrhotic liver nodule. Can Med Assoc J, 1969,100 : 567-572.
[7]Vilgrain V. Focal nodular hyperplasia. Eur J Radiol, 2006, 58 :236-245.
[8]Wanless
IR , Sapp H , Guindy M et al. Th e pathogenesis of focal nodular
hyperplasia: an hypothesis based on histologic review of 20 lesions
including 3 occurring in early biliary cirrhosis . Hepatology
2006;44:491a -105.
[9]Sato Y , Harada K , Ikeda H et al. Hepatic
stellate cells are activated around central scars of focal nodular
hyperplasia of the liver--a potential mechanism of central scar
formation . Hum Pathol 2009;40:181-8.
[10]Luciani A, Kobeiter H,
Maison P, et al. Focal nodular hyperplasia of the liver in men: is
presentation the same in men and women?. Gut. 2002;50(6):877-880.
[11]穆琳,陈忠萍,王萌,等.妊娠合并肝脏多发局灶性结节增生1例[J]. 实用放射学杂志,2020,36(10):1705-1706. DOI:10.3969/j.issn.1002-1671.2020.10.049.
[12]Weimann
A, Mössinger M, Fronhoff K, Nadalin S, Raab R. Pregnancy in women with
observed focal nodular hyperplasia of the liver. Lancet.
1998;351:1251–1252.
[13]Mathieu D, Kobeiter H, Maison P, Rahmouni A,
Cherqui D, Zafrani ES, et al. Oral contraceptive use and focal nodular
hyperplasia of the liver. Gastroenterology. 2000;118:560–564.
[14]D'halluin
V, Vilgrain V, Pelletier G, Rocher L, Belghiti J, Erlinger S, et al.
Natural history of focal nodular hyperplasia. A retrospective study of
44 cases. Gastroenterol Clin Biol. 2001;25:1008–1010.
苏州大学附属第一医院 苏州大学附属第一医院妇产科住院医师,医学硕士 2024年毕业于苏州大学临床5+3一体化专业。硕士期间研究课题:孕期血压变化趋势及临界高血压对健康适龄初产妇妊娠结局的影响。 苏州大学附属第一医院 北京协和医院妇产科医学博士,苏州大学附属第一医院产科主任医师,副教授,硕士生导师 ❖美国加州大学洛杉矶分校罗纳德里根医院妇产科母胎医学专业访问学者 ❖中国妇幼保健协会生育保健专业委员会委员 ❖中国医药教育协会围产医学教育专业委员会委员 ❖中国医疗保健国际交流促进会妇产科分会围产监护组委员 ❖中国医疗保健国际交流促进会围产与营养代谢学分会委员 参与并获得包括国家十一五公关项目《妇科肿瘤的规范化治疗》在内的多项国家级课题科研资助;参编《中国妇科肿瘤学》和《宋鸿钊滋养细胞肿瘤学》两部;发表SCI文章十余篇;擅长产前诊断和高危妊娠的治疗。 责编:孙雯 转载:妇产科网




